Hvilken type intermolekylære kræfter forekommer i meget flygtige væsker?
* volatilitet henviser til en væske, der er let til at fordampe til at fordampe. Dette betyder, at molekylerne i væsken let overvindes af termisk energi og flugt ud i gasfasen.
* Intermolekylære kræfter er de attraktive kræfter mellem molekyler. Stærke intermolekylære kræfter kræver mere energi til at overvinde, hvilket gør det sværere for molekyler at flygte ind i gasfasen.
Derfor har meget flygtige væsker svage intermolekylære kræfter . Disse kan omfatte:
* London Dispersion Forces (LDF): Dette er den svageste type intermolekylær kraft og er til stede i alle molekyler. De stammer fra midlertidige udsving i elektronfordeling.
* dipol-dipolinteraktioner: Disse forekommer mellem polære molekyler, der har permanente dipoler. Disse kræfter er stærkere end LDF, men stadig relativt svage.
* Hydrogenbinding: Dette er en speciel type dipol-dipolinteraktion, der opstår, når brint er bundet til et meget elektronegativt atom (som ilt, nitrogen eller fluor). Det er den stærkeste type intermolekylær kraft, men stadig relativt svag sammenlignet med de kovalente bindinger inden for molekyler.
Eksempler på meget flygtige væsker med svage intermolekylære kræfter:
* diethylether: Primært LDF
* acetone: LDF og dipol-dipol-interaktioner
* methanol: LDF, dipol-dipolinteraktioner og hydrogenbinding (men stadig svag nok til høj volatilitet)
Vigtig note: Selv væsker med hydrogenbinding kan være meget flygtige, hvis hydrogenbindingen er svag, eller molekylet er lille. For eksempel har methanol hydrogenbinding, men er stadig mere flygtigt end vand, fordi hydrogenbindingen i methanol er svagere, og molekylet er mindre.
 Varme artikler
Varme artikler
-
 Digitalisering og replikering af materialernes verdenKredit:Alain Herzog / Wenzel Jakob Er det muligt digitalt at kopiere den måde, lyset skinner på silke, kalejdoskopet af farver på sommerfuglevinger, eller strukturen af stoffer, plastik, og sten
Digitalisering og replikering af materialernes verdenKredit:Alain Herzog / Wenzel Jakob Er det muligt digitalt at kopiere den måde, lyset skinner på silke, kalejdoskopet af farver på sommerfuglevinger, eller strukturen af stoffer, plastik, og sten -
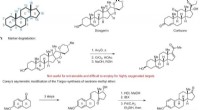 Strømlinet proces åbner lægemiddeludvikling til en ny klasse af steroiderIntroduktion til steroidstruktur og syntese. en, Det generelle steroid tetracykliske skelet. b, Eksempler på naturlige steroider. c, Udvalgte metoder til steroidsyntese ved hjælp af semisyntetiske og
Strømlinet proces åbner lægemiddeludvikling til en ny klasse af steroiderIntroduktion til steroidstruktur og syntese. en, Det generelle steroid tetracykliske skelet. b, Eksempler på naturlige steroider. c, Udvalgte metoder til steroidsyntese ved hjælp af semisyntetiske og -
 Kemikere opdager, hvordan blåt lys fremskynder blindhedDr. Ajith Karunarathne undersøgte giftig iltgenerering af retinal under eksponering for blåt lys. Kredit:Dan Miller, Universitetet i Toledo Blåt lys fra digitale enheder og solen forvandler vitale
Kemikere opdager, hvordan blåt lys fremskynder blindhedDr. Ajith Karunarathne undersøgte giftig iltgenerering af retinal under eksponering for blåt lys. Kredit:Dan Miller, Universitetet i Toledo Blåt lys fra digitale enheder og solen forvandler vitale -
 Studerer gasmaskefiltre, så folk kan trække vejret lettereKobber, vist her, er en komponent i filtre, der bruges i gasmasker for at beskytte brugere mod giftige kemikalier. Forskere ved Berkeley Lab bruger kraftig røntgenspektroskopi til at studere de moleky
Studerer gasmaskefiltre, så folk kan trække vejret lettereKobber, vist her, er en komponent i filtre, der bruges i gasmasker for at beskytte brugere mod giftige kemikalier. Forskere ved Berkeley Lab bruger kraftig røntgenspektroskopi til at studere de moleky
- Meget hård rock, der brænder med en høj varme og lidt røg. En metamorf dannet af kul?
- Skjulte mellemrumstilstande på vejen til halvledernanokrystaller
- Hvad er to slags celler, der udfører specialiserede funktioner hos mennesker?
- Hvad skal man vide om Boeings første rumflyvning med NASA-astronauter
- Hvad hedder planeterne efter?
- En to-atom kvante duet


