Forklar, hvordan en gas udøver tryk på siderne af dens beholder?
1. Konstant bevægelse: Gasmolekylerne er i konstant, tilfældig bevægelse. De bevæger sig i lige linjer, indtil de kolliderer med noget - enten et andet molekyle eller containervæggene.
2. Kollisioner: Når et molekyle kolliderer med beholderens væg, udøver den en kraft på den. Denne kraft er et lille skub, men fordi der er millioner af molekyler, der konstant kolliderer med væggene, tilføjer disse kræfter sig.
3. Tryk er kraft pr. Område: Tryk er defineret som den kraft, der udøves pr. Enhedsareal. Da gasmolekylerne konstant rammer væggene, resulterer den samlede kraft, de udøver over hele overfladearealet af beholderen, i tryk.
4. Faktorer, der påvirker pres:
* Flere molekyler: Jo flere gasmolekyler der er i en beholder, jo flere kollisioner med væggene, og derfor, jo højere er trykket. Dette er grunden til, at komprimering af en gas øger sit tryk.
* hurtigere molekyler: Hvis molekylerne bevæger sig hurtigere (højere temperatur), rammer de væggene med mere kraft og hyppigere, hvilket fører til højere tryk.
* mindre beholder: Hvis beholderen er mindre, har molekylerne mindre plads til at bevæge sig rundt i. Dette betyder, at de kolliderer med væggene oftere, hvilket øger trykket.
Kort sagt: Presset af en gas er et direkte resultat af den konstante bombardement af dens molekyler mod containervæggene. Jo flere kollisioner, jo højere er presset.
 Varme artikler
Varme artikler
-
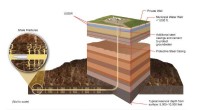 Producerer gavnlig propylen, mens der forbruges en større drivhusgasProducerbare dele af skifergasformationer er placeret mange tusinde fod under landoverfladen, langt under underjordiske drikkevandskilder (USDW). Moderne hydraulisk fraktureringsteknologi involverer s
Producerer gavnlig propylen, mens der forbruges en større drivhusgasProducerbare dele af skifergasformationer er placeret mange tusinde fod under landoverfladen, langt under underjordiske drikkevandskilder (USDW). Moderne hydraulisk fraktureringsteknologi involverer s -
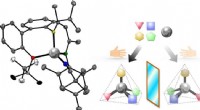 Forskere udvikler katalysator med chiralitet i zinkcentretKonstruktion af chiral zink med høj konfigurationsstabilitet. Til venstre:Molekylær struktur af tetraedrisk chiral zink-kompleks. Den chirale tetraedriske forbindelse har en zinkion i midten (grå kugl
Forskere udvikler katalysator med chiralitet i zinkcentretKonstruktion af chiral zink med høj konfigurationsstabilitet. Til venstre:Molekylær struktur af tetraedrisk chiral zink-kompleks. Den chirale tetraedriske forbindelse har en zinkion i midten (grå kugl -
 Ny enhed opdager hurtigt skadelige bakterier i blodetBakterieceller fanget i en 3D mikroperlematrix. Kredit:Wenrong He/Rochester Institute of Technology. Ingeniører har skabt en lillebitte enhed, der hurtigt kan opdage skadelige bakterier i blodet,
Ny enhed opdager hurtigt skadelige bakterier i blodetBakterieceller fanget i en 3D mikroperlematrix. Kredit:Wenrong He/Rochester Institute of Technology. Ingeniører har skabt en lillebitte enhed, der hurtigt kan opdage skadelige bakterier i blodet, -
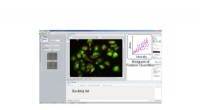 Forskere udvikler cellesugende teknologiPrikker i Histogram Feature Quantities svarer til hver celle. Vælg og klik på prikkerne på histogrammet for at bestemme, hvilke celler der skal suges. T baseret på de forudindstillede funktionsmængder
Forskere udvikler cellesugende teknologiPrikker i Histogram Feature Quantities svarer til hver celle. Vælg og klik på prikkerne på histogrammet for at bestemme, hvilke celler der skal suges. T baseret på de forudindstillede funktionsmængder
- Skaber miljøvenlige lyddæmpere fra tang
- Hvordan finder du 68 millimeter på en lineal?
- Historien om, hvordan swahili blev Afrikas mest talte sprog
- Undersøgelse giver nyt perspektiv på boligkrakket i 2008
- Hvad er stjernerne med en masse 1,5 gange større end solen?
- Langsigtet flydende vand også på ikke-jordlignende planeter?


