Hvordan adskiller elektroner i det samme atom?
1. Energiniveau (shell):
* hovedkantenummer (n): Dette tal definerer elektronens energiniveau. Højere 'n' værdier indikerer højere energiniveau, længere fra kernen. For eksempel har en elektron i den første skal (n =1) lavere energi end et elektron i den anden skal (n =2).
2. Subshell (Orbital):
* vinkelmomentumnummer (L): Dette nummer beskriver formen på elektronens orbital. For en given 'n' er der flere underskaller:
* L =0:S Orbital (sfærisk)
* L =1:P orbital (håndvægtformet)
* L =2:D Orbital (mere komplekse former)
* l =3:f orbital (endnu mere komplekse former)
* Magnetisk kvantenummer (ML): Dette antal specificerer orienteringen af orbitalen i rummet. For eksempel har en P orbital tre mulige orienteringer (ML =-1, 0, +1).
3. Spin:
* spin kvantenummer (MS): Dette nummer beskriver den iboende vinkelmoment for et elektron, der kvantificeres og benævnes "spin." En elektron kan dreje "op" (MS =+1/2) eller "ned" (MS =-1/2).
for at opsummere:
* Elektroner i det samme atom kan have forskellige energiniveauer (n).
* Inden for et givet energiniveau kan elektroner besætte forskellige underskaller (L) og orbitaler (ML).
* Endelig har hver elektron sin egen unikke spin (MS).
Pauli Exclusion Principle:
* Pauli -eksklusionsprincippet siger, at ingen to elektroner i et atom kan have det samme sæt med fire kvantetal (N, L, ML, MS). Dette princip sikrer, at hver elektron optager en unik tilstand inden for atomet.
 Varme artikler
Varme artikler
-
 Datakraft løser molekylært mysteriumForskere måtte studere næsten 100, 000 simuleringsbilleder af denne type, før de kunne identificere, hvad der får vandmolekylerne til at splitte. Masser af computerkraft gik til disse simuleringer. Kr
Datakraft løser molekylært mysteriumForskere måtte studere næsten 100, 000 simuleringsbilleder af denne type, før de kunne identificere, hvad der får vandmolekylerne til at splitte. Masser af computerkraft gik til disse simuleringer. Kr -
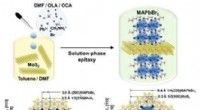 Ukonventionel løsningsproces til 2-D heterostrukturSkematisk model af MAPbBr3 || MoS2 epitaksialt forhold. Kredit:Science China Press Opløsningsforarbejdede overgangsmetalchalcogenid (TMD) nanosheets udviser begrænset lysabsorption og lav kvanteef
Ukonventionel løsningsproces til 2-D heterostrukturSkematisk model af MAPbBr3 || MoS2 epitaksialt forhold. Kredit:Science China Press Opløsningsforarbejdede overgangsmetalchalcogenid (TMD) nanosheets udviser begrænset lysabsorption og lav kvanteef -
 De stiveste porøse letvægtsmaterialer nogensindePladegitter er det valgmæssige design til fremtidige lette porøse materialer. Kredit:ETH Zürich / Marc Day Forskere ved ETH har udviklet og fremstillet en familie af arkitekturer, der maksimerer s
De stiveste porøse letvægtsmaterialer nogensindePladegitter er det valgmæssige design til fremtidige lette porøse materialer. Kredit:ETH Zürich / Marc Day Forskere ved ETH har udviklet og fremstillet en familie af arkitekturer, der maksimerer s -
 Højindeks overflade-eksponerede nanodendritter som ORR elektrokatalysatorVed hjælp af en atmosfære -skiftende strategi efterfulgt af elektrokemisk dealloying, forskere har syntetiseret sammensætningsgraderet PtCu 3 @Pt 3 Cu@Pt nanodendritter, der blotlægger overflader
Højindeks overflade-eksponerede nanodendritter som ORR elektrokatalysatorVed hjælp af en atmosfære -skiftende strategi efterfulgt af elektrokemisk dealloying, forskere har syntetiseret sammensætningsgraderet PtCu 3 @Pt 3 Cu@Pt nanodendritter, der blotlægger overflader
- Hvad genanvendes ikke ved respiration af celler?
- Hæmmet af scientisme? Forsker undersøger historien om amerikansk samfundsvidenskab
- Virkelige ansøgninger om gaslovgivning
- Hvad er tre egenskaber, som alle mineraler har til fælles?
- Hvorfor tiden to gange i enhedsacceleration?
- Sådan fodrer du en invaderende hær tusindvis af kilometer hjemmefra


