Hvad er elektronkonfigurationen i aluminium?
1S² 2S² 2P⁶ 3S² 3P¹
Sådan nedbrydes det:
* 1S²: Det første energiniveau (n =1) har et underskal, "S" -subskalet, der indeholder 2 elektroner.
* 2s²: Det andet energiniveau (n =2) har to underskaller, "S" (har 2 elektroner) og "P" (har 6 elektroner).
* 2p⁶: Underskalet "P" i det andet energiniveau er fyldt med 6 elektroner.
* 3S²: Det tredje energiniveau (n =3) starter med "S" underskalet, der holder 2 elektroner.
* 3p¹: Underskalet "P" i det tredje energiniveau har kun 1 elektron.
forenklet notation: Du kan også skrive dette som [ne] 3s² 3p¹ , hvor "[NE]" repræsenterer elektronkonfigurationen af neon, som er den foregående ædle gas.
Sidste artikelHvad er elektronkonfigurationen af MGSO4?
Næste artikelHvad er 3 fysiske egenskaber ved en Oreo?
 Varme artikler
Varme artikler
-
 Papirspor fører til hjerteklap opdagelserRisforskere konfigurerer lagdelt filterpapir til at efterligne aorta-hjerteklapper. Kredit:Jeff Fitlow Papir er kernen i en eksperimentel enhed udviklet af Rice University bioingeniører til at stu
Papirspor fører til hjerteklap opdagelserRisforskere konfigurerer lagdelt filterpapir til at efterligne aorta-hjerteklapper. Kredit:Jeff Fitlow Papir er kernen i en eksperimentel enhed udviklet af Rice University bioingeniører til at stu -
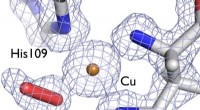 Indsigt i enzymers 3D-struktur kan reducere omkostningerne til biobrændstofAt forstå strukturen af et enzym, der hjælper bakterier med at nedbryde cellulose og kitin i træagtige plantefibre, kan hjælpe med at udvikle bedre biobrændstoffer. På dette billede, et elektrontæth
Indsigt i enzymers 3D-struktur kan reducere omkostningerne til biobrændstofAt forstå strukturen af et enzym, der hjælper bakterier med at nedbryde cellulose og kitin i træagtige plantefibre, kan hjælpe med at udvikle bedre biobrændstoffer. På dette billede, et elektrontæth -
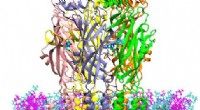 Supersimuleringer giver frisk indsigt i serotoninreceptorerKredit:A. James Clark School of Engineering, University of Maryland Forskere ved University of Maryland (UMD) og National Institute of Standards and Technology (NIST) har opdaget en måde at opdage
Supersimuleringer giver frisk indsigt i serotoninreceptorerKredit:A. James Clark School of Engineering, University of Maryland Forskere ved University of Maryland (UMD) og National Institute of Standards and Technology (NIST) har opdaget en måde at opdage -
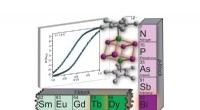 Forskere skaber en magnet lavet af ét molekyleGrafisk abstrakt. Kredit:Chem (2021). DOI:10.1016/j.chempr.2021.11.007 Nogle gange kræver det at lave en helt ny type boks, at man tænker uden for boksen, hvilket er præcis, hvad spartanske kemiker
Forskere skaber en magnet lavet af ét molekyleGrafisk abstrakt. Kredit:Chem (2021). DOI:10.1016/j.chempr.2021.11.007 Nogle gange kræver det at lave en helt ny type boks, at man tænker uden for boksen, hvilket er præcis, hvad spartanske kemiker
- Hvad er pH i enzymeraktivitet?
- Ny maser i en skoæske lover bærbar præcision
- Liste over typer dyr adfærd
- Når en bølge skaber stærk under tå, hvilken slags er det?
- Målt strømspændingskurve for grafen nanobånd, med konsekvenser for grafenafbrydere
- Er det muligt at se en kunstig satellit på nattehimlen?


