Brug det, du ved om partiklerne i en gas for at forklare, hvorfor har ingen bestemt form og volumen?
1. Gaspartikler er langt fra hinanden:
* I modsætning til faste stoffer og væsker er gaspartikler bredt adskilt. Der er en masse tomme mellemrum mellem dem.
* Denne store afstand mellem partikler betyder, at de oplever meget svage attraktive kræfter mellem hinanden.
2. Gaspartikler bevæger sig tilfældigt:
* Gaspartikler er konstant i hurtig, tilfældig bevægelse. De kolliderer med hinanden og væggene i deres beholder.
* Denne konstante bevægelse med høj hastighed betyder, at partiklerne ikke forbliver i faste positioner.
3. Mangel på bestemt form:
* Fordi gaspartikler bevæger sig frit og ikke holdes i en fast position, kan de sprede sig for at udfylde enhver beholder, de besætter.
* De tager formen på deres beholder, fordi de ikke holdes sammen af stærke intermolekylære kræfter.
4. Mangel på bestemt volumen:
* De svage kræfter mellem gaspartikler betyder, at de let kan komprimeres.
* Hvis du anvender tryk, tvinges partiklerne tættere sammen, hvilket reducerer volumenet gassen optager.
* Hvis du reducerer trykket, udvides gassen til at fylde den tilgængelige plads.
Kortfattet:
Kombinationen af disse egenskaber - vidt adskilte partikler, tilfældig bevægelse og svage intermolekylære kræfter - betyder, at gaspartikler har fuldstændig bevægelsesfrihed. Denne frihed giver gasser mulighed for at udvide til at fylde enhver beholder og let ændre deres volumen som respons på trykændringer.
 Varme artikler
Varme artikler
-
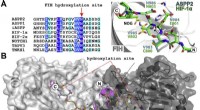 Hydroxyleringen af ASPP2 og andre ankyrin-gentagelsesdomæneproteinerUdsigter fra krystalstrukturer af FIH i kompleks med ASPP-afledte peptider. En (venstre) sekvensjustering af ASPP-proteiner med rapporterede FIH-substrater. (Højre) Overlejring af krystalstrukturafled
Hydroxyleringen af ASPP2 og andre ankyrin-gentagelsesdomæneproteinerUdsigter fra krystalstrukturer af FIH i kompleks med ASPP-afledte peptider. En (venstre) sekvensjustering af ASPP-proteiner med rapporterede FIH-substrater. (Højre) Overlejring af krystalstrukturafled -
 Forskere opdager nøglemekanismen bag dannelsen af edderkoppesilkeKredit:CC0 Public Domain En gruppe videnskabsmænd ledet af forskere fra RIKEN Center for Sustainable Resource Science (CSRS) har undersøgt den opløselige forløber for edderkoppesilke og fundet ud
Forskere opdager nøglemekanismen bag dannelsen af edderkoppesilkeKredit:CC0 Public Domain En gruppe videnskabsmænd ledet af forskere fra RIKEN Center for Sustainable Resource Science (CSRS) har undersøgt den opløselige forløber for edderkoppesilke og fundet ud -
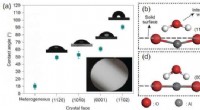 Safirer viser deres sande farver:Ikke vandelskendeMakroskopiske befugtningsforskelle af forskellige α-Al2O3 krystalflader og skematiske diagrammer for at illustrere mekanismen på molekylært niveau. (a) Polykrystallinsk aluminiumoxid er meget hydrofil
Safirer viser deres sande farver:Ikke vandelskendeMakroskopiske befugtningsforskelle af forskellige α-Al2O3 krystalflader og skematiske diagrammer for at illustrere mekanismen på molekylært niveau. (a) Polykrystallinsk aluminiumoxid er meget hydrofil -
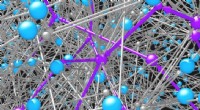 Deep learning -teknikker lærer neurale modeller at spille retrosynteseMolekyler (blå kugler) er forbundet med hinanden ved reaktionerne (grå kugler og pile), som de deltager i. Netværket af mulige organiske molekyler og reaktioner er umuligt stort. Intelligente søgealgo
Deep learning -teknikker lærer neurale modeller at spille retrosynteseMolekyler (blå kugler) er forbundet med hinanden ved reaktionerne (grå kugler og pile), som de deltager i. Netværket af mulige organiske molekyler og reaktioner er umuligt stort. Intelligente søgealgo
- Hvad er definitionen af tid ifølge Einstein?
- Hvad er navnet, der gives til en kemisk reaktion med ilt?
- Hvad er de tre store lag af geosfæren?
- Hvor mange inches er 89 mm?
- Udlændinge bedragere:Planeter med ilt har ikke nødvendigvis liv
- Kan radikalisering besejres? Ja, hvis vi forstår, at det sker, når folks bånd brydes


