Former overgangsmetallerne kationer eller anioner?
Her er hvorfor:
* Elektronkonfiguration: Overgangsmetaller har en delvist fyldt d orbital. De har en tendens til at miste elektroner fra deres S- og D -orbitaler for at opnå en mere stabil elektronkonfiguration. Dette tab af elektroner resulterer i dannelsen af positivt ladede ioner (kationer).
* Elektropositivitet: Overgangsmetaller er generelt elektropositive, hvilket betyder, at de har en tendens til at miste elektroner og danne positive ioner.
* Oxidation siger: Overgangsmetaller udviser variable oxidationstilstande, hvilket er et direkte resultat af deres evne til at miste forskellige antal elektroner.
Eksempler:
* Jern (Fe) danner Fe²⁺⁺ og Fe³⁺ -kationer.
* Kobber (Cu) danner Cu⁺ og ku²⁺ -kationer.
* Zink (Zn) danner Zn²⁺ -kationer.
Undtagelser:
* Nogle overgangsmetaller kan danne anioner under specifikke forhold. For eksempel kan mangan (Mn) danne Mno₄⁻ (permanganat) anion.
Imidlertid er dannelsen af anioner ved overgangsmetaller mindre almindelig end dannelsen af kationer.
 Varme artikler
Varme artikler
-
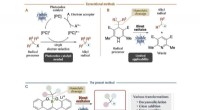 Ny protokol for organisk syntese ved hjælp af organoboronforbindelser og synligt lysSammenligning af konventionelle metoder og den foreliggende metode Credit:Kanazawa University Alkylradikaler er carbonradikaler af normale og forgrenede alkaner, tilgængelig som reaktionsmellempro
Ny protokol for organisk syntese ved hjælp af organoboronforbindelser og synligt lysSammenligning af konventionelle metoder og den foreliggende metode Credit:Kanazawa University Alkylradikaler er carbonradikaler af normale og forgrenede alkaner, tilgængelig som reaktionsmellempro -
 Ny undersøgelse øger forståelsen for, hvordan antibiotikaresistens opstårKredit:CC0 Public Domain Hvordan opstår antibiotikaresistens? I en ny artikel i juli -nummeret af Journal of Biological Chemistry forskere fra Uppsala Universitet viser, hvordan et bakterielt en
Ny undersøgelse øger forståelsen for, hvordan antibiotikaresistens opstårKredit:CC0 Public Domain Hvordan opstår antibiotikaresistens? I en ny artikel i juli -nummeret af Journal of Biological Chemistry forskere fra Uppsala Universitet viser, hvordan et bakterielt en -
 Gennembrud i molekylære maskinerKunstnerfortolkning af en molekylær maskine. Kredit:Mikkel Larris, Syddansk Universitet Molekyler er nogle af livets mest basale byggesten. Når de arbejder sammen på den rigtige måde, de bliver mo
Gennembrud i molekylære maskinerKunstnerfortolkning af en molekylær maskine. Kredit:Mikkel Larris, Syddansk Universitet Molekyler er nogle af livets mest basale byggesten. Når de arbejder sammen på den rigtige måde, de bliver mo -
 Røntgenlaserundersøgelse identificerer krystallinsk mellemprodukt i vores vej til vejrtrækningAustin Echelmeir (venstre til højre), Alexandra Ros, Petra Fromme og Raimund Fromme alle fra ASUs School of Molecular Sciences og Biodesign Institutes Center for Applied Structural Discovery. Kredit:M
Røntgenlaserundersøgelse identificerer krystallinsk mellemprodukt i vores vej til vejrtrækningAustin Echelmeir (venstre til højre), Alexandra Ros, Petra Fromme og Raimund Fromme alle fra ASUs School of Molecular Sciences og Biodesign Institutes Center for Applied Structural Discovery. Kredit:M
- Hvad er en resonans i kemi?
- Hvad er det sammensatte navn på BL3?
- Genskab betingelser inde i stjerner med kompakte lasere
- Hvordan kommer nitrogen fra levende organismer tilbage til luften?
- Forskere har yderligere forståelse for en proces, der forårsager varmetab i fusionsenheder
- Hvad refererer til de fysiske træk i en region.?


