Hvad er en resonans i kemi?
Her er en sammenbrud:
Nøglekoncepter:
* delokalisering: Elektroner er ikke begrænset til en enkelt binding eller atom, men snarere spredt ud over flere atomer.
* Resonansstrukturer: Flere Lewis -strukturer drages for at repræsentere delokaliseringen af elektroner. Disse strukturer er ikke reelle, men snarere teoretiske repræsentationer, der hjælper os med at forstå bindingen.
* resonanshybrid: Den sande struktur af molekylet er en hybrid eller gennemsnit af alle resonansstrukturer, hvor elektronerne distribueres over alle de involverede atomer.
Hvorfor er resonans vigtig?
* stabilitet: Molekyler med resonans er generelt mere stabile end dem uden det. Dette skyldes, at delokaliseringen af elektroner sænker molekylets samlede energi.
* reaktivitet: Resonans kan påvirke, hvordan et molekyle reagerer med andre molekyler.
* bindingslængder og styrker: Resonans kan påvirke bindingslængder og styrker ved at sprede elektrondensitet.
Eksempel:benzen
Benzen (C 6 H 6 ) er et klassisk eksempel på resonans. Det har en ring med seks carbonatomer med skiftende enkelt- og dobbeltbindinger.
* enkelt Lewis -struktur: En enkelt Lewis-struktur kan ikke nøjagtigt repræsentere bindingen i benzen, fordi alle carbon-carbonbindinger er ækvivalente i længden.
* Resonansstrukturer: Vi tegner to resonansstrukturer for benzen, hvor dobbeltbindingerne forskydes rundt om ringen.
* resonanshybrid: Den sande struktur af benzen er en hybrid af disse to resonansstrukturer med elektronerne, der er delokaliseret over hele ringen.
Sammenfattende er resonans et værdifuldt værktøj i kemi til at beskrive bindingen i molekyler, hvor en enkelt Lewis -struktur ikke er tilstrækkelig. Det hjælper os med at forstå stabiliteten, reaktiviteten og andre egenskaber ved molekyler med delokaliserede elektroner.
 Varme artikler
Varme artikler
-
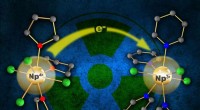 Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces
Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces -
 Justering af nøjagtige forhold mellem to metaller i en katalysator kan muliggøre nye retninger ind…Michael Janik (til venstre), professor i kemiteknik i Penn State, og Robert Rioux, professor i kemiteknik fra Penn State, Friedrich G. Helfferich, udgav et Nature Chemistry-papir, hvori de testede eff
Justering af nøjagtige forhold mellem to metaller i en katalysator kan muliggøre nye retninger ind…Michael Janik (til venstre), professor i kemiteknik i Penn State, og Robert Rioux, professor i kemiteknik fra Penn State, Friedrich G. Helfferich, udgav et Nature Chemistry-papir, hvori de testede eff -
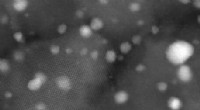 Direkte syntese af hydrogenperoxid ved hjælp af TS-1 understøttede katalysatorerHAADF-billeder af 2,4% Au - 2,4% Pd - 0,2% Pt / TS-1 calcineret prøve. Kredit:Dr Qian He Hydrogenperoxid (H 2 O 2 ) har mange industrielle anvendelser, fra vandbehandling og blegning til kemis
Direkte syntese af hydrogenperoxid ved hjælp af TS-1 understøttede katalysatorerHAADF-billeder af 2,4% Au - 2,4% Pd - 0,2% Pt / TS-1 calcineret prøve. Kredit:Dr Qian He Hydrogenperoxid (H 2 O 2 ) har mange industrielle anvendelser, fra vandbehandling og blegning til kemis -
 Hurtig test til diagnosticering af astmaDet holografiske mikroskop muliggør automatisk, tredimensionel sporing af immunceller i realtid. Kredit:Fraunhofer-Gesellschaft Astma er en af de mest almindelige luftvejssygdomme i verden, påvi
Hurtig test til diagnosticering af astmaDet holografiske mikroskop muliggør automatisk, tredimensionel sporing af immunceller i realtid. Kredit:Fraunhofer-Gesellschaft Astma er en af de mest almindelige luftvejssygdomme i verden, påvi
- Hvilken berømt overtro er relateret til kometer?
- Hvad er usorterede sedimenter?
- Ny forskning kan kaste lys over, hvordan kuldioxidudslip fra det sydlige Ocean kan påvirke klimaæn…
- Forskere udvikler molekyle til lagring af solenergi
- Genanvendeligt, sukker-afledt skum - et fornybart alternativ til traditionelle polyurethaner?
- Plastmikrofibre fundet for første gang i afføring af vilde dyr, fra sydamerikanske pels sæler


