Hvis du har to stoffer, der er i samme størrelse og lignende densiteter, hvordan ville de forskellige kogepunkter adskille dem?
destillationsprocessen:
1. Opvarmning: Blandingen af stoffer opvarmes.
2. fordampning: Stoffet med det lavere kogepunkt vil først fordampe (blive til en gas).
3. Kondens: Dampen afkøles derefter, hvilket får den til at kondensere tilbage til en væske.
4. samling: Den kondenserede væske (stoffet med det lavere kogepunkt) opsamles separat.
5. Gentag: Denne proces kan gentages for yderligere at adskille stofferne, især hvis deres kogepunkter er tæt sammen.
Hvorfor dette fungerer:
* kogepunkt: Hvert stof har en specifik temperatur, hvormed det skifter fra en væske til en gas. Stoffet med det lavere kogepunkt fordamper først.
* damptryk: Et stofs damptryk er det tryk, som det damp udøver, når den er i ligevægt med sin flydende fase. Stoffet med det lavere kogepunkt har et højere damptryk ved en given temperatur, hvilket gør det lettere at fordampe.
Eksempel:
Tænk på at adskille vand (kogepunkt 100 ° C) og ethanol (kogepunkt 78 ° C). Du kan opvarme blandingen, indtil ethanolen fordampes og efterlader vandet. Ethanoldampen kunne derefter opsamles ved at afkøle den.
Nøglepunkter:
* Lignende densiteter: Forskellen i densiteter spiller ikke en vigtig rolle i destillation.
* Samme størrelse: Størrelsen på molekylerne betyder ikke så meget som deres kogepunkter.
* fraktioneret destillation: For stoffer med meget tæt kogepunkter anvendes der en mere kompleks metode kaldet fraktioneret destillation. Denne metode involverer at bruge en søjle med mange overflader for at give flere muligheder for fordampning og kondens.
Fortæl mig, hvis du gerne vil udforske nogen af disse koncepter mere detaljeret!
 Varme artikler
Varme artikler
-
 Hydrogenering uden brint:Effektiv katalyse i en stabil emulsionsgelKredit:Transmission Electron Microscope (TEM) billeder af Dele Peter Fapojuwo, Universitetet i Johannesburg. Grafisk design af Therese van Wyk, Universitetet i Johannesburg. UJ-forskere tager et n
Hydrogenering uden brint:Effektiv katalyse i en stabil emulsionsgelKredit:Transmission Electron Microscope (TEM) billeder af Dele Peter Fapojuwo, Universitetet i Johannesburg. Grafisk design af Therese van Wyk, Universitetet i Johannesburg. UJ-forskere tager et n -
 Syntetisering af sukker:Kemikere udvikler metode til at forenkle opbygning af kulhydraterKredit:ACS Kulhydrater er komplekse molekyler, svært at syntetisere i laboratoriet, men det er nyttigt at studere gavnlige sukkerarter, såsom dem, der findes i modermælk, eller gør det muligt for
Syntetisering af sukker:Kemikere udvikler metode til at forenkle opbygning af kulhydraterKredit:ACS Kulhydrater er komplekse molekyler, svært at syntetisere i laboratoriet, men det er nyttigt at studere gavnlige sukkerarter, såsom dem, der findes i modermælk, eller gør det muligt for -
 Konstrueret protein inspireret af naturen kan hjælpe med plastikpestMutationer af et PET-hydrolyserende enzym PET2 resulterede i en stigning på 6,7 grader C i termisk stabilitet og en 6,8 gange stigning i PET-hydrolytisk aktivitet. T m repræsenterer smeltetemperatur
Konstrueret protein inspireret af naturen kan hjælpe med plastikpestMutationer af et PET-hydrolyserende enzym PET2 resulterede i en stigning på 6,7 grader C i termisk stabilitet og en 6,8 gange stigning i PET-hydrolytisk aktivitet. T m repræsenterer smeltetemperatur -
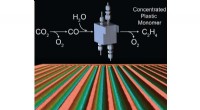 Effektive elektrokemiske celler til CO2-omdannelseDenne illustration er en kunstners gengivelse af elektrolyseprocessen, der bruges til at omdanne CO2 til koncentrerede kulstofprodukter. Kredit:Ripatti et al. Forskere ved Stanford University ha
Effektive elektrokemiske celler til CO2-omdannelseDenne illustration er en kunstners gengivelse af elektrolyseprocessen, der bruges til at omdanne CO2 til koncentrerede kulstofprodukter. Kredit:Ripatti et al. Forskere ved Stanford University ha
- Hvad betyder ros havet, men holder sig på land?
- Hvilke rejser med en større hastighed ultraviolet lys eller infrarød?
- Hvad er en miljømæssig egenskab?
- Hvad hedder lette stråler fra solen?
- Hvad vi gør - og ikke ved om Pentagons hemmelige ufo-program
- Udvikling af verdens første vertikale galliumoxidtransistor gennem ionimplantationsdoping


