Hvordan opfører luftmolekyler sig i et lukket miljø?
1. Konstant bevægelse:
* Luftmolekyler er konstant i bevægelse og bevæger sig tilfældigt i alle retninger.
* De kolliderer med hinanden og med containerens vægge.
* Denne konstante bevægelse er det, der skaber lufttryk.
2. Tryk og volumen:
* Boyle's lov: I et lukket miljø, ved konstant temperatur, er gasens tryk omvendt proportionalt med det volumen, den optager.
* Dette betyder, at hvis du klemmer beholderen (reducer lydstyrken), vil trykket indeni stige.
* Charles 'lov: Ved konstant tryk er volumenet af en gas direkte proportional med dens absolutte temperatur.
* Dette betyder, at hvis du opvarmer gassen (øg temperaturen), udvides volumenet.
3. Temperatur og kinetisk energi:
* Temperaturen på en gas er direkte relateret til den gennemsnitlige kinetiske energi for dens molekyler.
* Højere temperatur betyder, at molekyler bevæger sig hurtigere og har mere kinetisk energi.
* Ideel gaslov: Denne lov kombinerer tryk, volumen, temperatur og antallet af molekyler (mol) i en ligning:PV =NRT, hvor R er den ideelle gaskonstant.
4. Diffusion:
* Luftmolekyler vil naturligt diffundere gennem beholderen og bevæger sig fra områder med høj koncentration til lav koncentration.
* Dette er grunden til, at hvis du åbner en flaske parfume i et rum, lugter du den til sidst overalt.
5. Ligevægt:
* Over tid, i et lukket miljø, når luftmolekylerne en ligevægtstilstand.
* Dette betyder, at trykket, temperaturen og densiteten vil være relativt konstant i hele beholderen.
6. Interaktioner:
* Mens luftmolekyler for det meste er uafhængige, interagerer de med hinanden.
* Disse interaktioner er svage, især ved normale temperaturer og tryk.
* Men de kan have en indflydelse på gasens opførsel, især ved høje tryk eller lave temperaturer.
Eksempler:
* En ballon: Luften indeni holdes ved et højere tryk end den udvendige luft, hvorfor ballonen udvides. Hvis du opvarmer ballonen, udvides luften inde yderligere, hvilket øger trykket og gør ballonen større.
* en forseglet flaske: Hvis du ryster flasken, kolliderer luftmolekylerne inde med væggene og skaber tryk. Hvis du opvarmer flasken, vil luften indeni udvides, hvilket potentielt får flasken til at bryde.
Vigtige noter:
* Dette er en forenklet forklaring. Den faktiske opførsel af luftmolekyler i et lukket miljø kan være ret kompliceret og påvirkes af faktorer som fugtighed, luftesammensætning og tilstedeværelsen af andre stoffer.
* Opførelsen af luftmolekyler kan påvirkes af størrelsen og formen på beholderen. For eksempel vil luftmolekyler i en lille beholder kollideret oftere end i en stor beholder.
* Mens luftmolekyler konstant bevæger sig, rejser de ikke nødvendigvis i lige linjer. De bevæger sig på en tilfældig, kaotisk måde, kolliderer konstant med hinanden og skifter retning.
 Varme artikler
Varme artikler
-
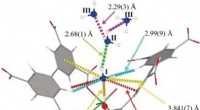 Et robust materiale til optagelse og opbevaring af ammoniak ved tætheder, der kommer tæt på den f…Kredit:Wiley Håndtering, opbevaring, og forsendelse af ammoniak kræver dyrt udstyr og særlige forholdsregler på grund af dets iboende ætsende og toksiske egenskaber. Forskere i Manchester, Storbri
Et robust materiale til optagelse og opbevaring af ammoniak ved tætheder, der kommer tæt på den f…Kredit:Wiley Håndtering, opbevaring, og forsendelse af ammoniak kræver dyrt udstyr og særlige forholdsregler på grund af dets iboende ætsende og toksiske egenskaber. Forskere i Manchester, Storbri -
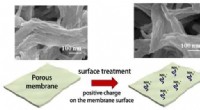 Udvikling af ultratynd holdbar membran til effektiv olie- og vandseparationFigur 1:SEM-billeder og diagram, der viser dannelsen af det ultratynde silicalag på den porøse membran. Kredit:Kobe University Forskere ledet af professor Matsuyama Hideto og professor Yoshioka
Udvikling af ultratynd holdbar membran til effektiv olie- og vandseparationFigur 1:SEM-billeder og diagram, der viser dannelsen af det ultratynde silicalag på den porøse membran. Kredit:Kobe University Forskere ledet af professor Matsuyama Hideto og professor Yoshioka -
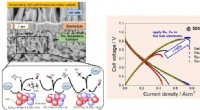 Forskere udvikler højtydende keramisk brændselscelle, der fungerer på butangasNår nikkelkatalysatoren i keramiske brændselsceller bruges sammen med kulbrintebrændstoffer, såsom metan, propan, og butan, det kulstof, der dannes under brændstofomdannelsen, aflejres på overfladen a
Forskere udvikler højtydende keramisk brændselscelle, der fungerer på butangasNår nikkelkatalysatoren i keramiske brændselsceller bruges sammen med kulbrintebrændstoffer, såsom metan, propan, og butan, det kulstof, der dannes under brændstofomdannelsen, aflejres på overfladen a -
 Kontrol af kunstige cilia med magnetfelter og lysFotografi af en række magnetiske cilia foldet og holdt i spidsen af pincet. Kredit:Jessica A.-C. Liu Forskere fra North Carolina State University og Elon University har lavet kunstige cilia, ell
Kontrol af kunstige cilia med magnetfelter og lysFotografi af en række magnetiske cilia foldet og holdt i spidsen af pincet. Kredit:Jessica A.-C. Liu Forskere fra North Carolina State University og Elon University har lavet kunstige cilia, ell
- Hvordan offentlige pensionsfonde kan hjælpe med at håndtere klimaændringer
- B₄C–TiB₂ kompositkeramik med justerbare mekaniske og elektriske egenskaber
- Hvad er eksempler på stødende rock?
- Opbygning af den ultimative lysdetektor
- På hvilke af følgende måder kan energi rejse gennem tomt rum?
- Hvilken form for energi får et objekt fra sin bevægelse?


