Hvilke elektroner bruges til at fremstille bindinger?
Her er hvorfor:
* Valenselektroner: Dette er de elektroner, der findes i den yderste skal af et atom. Det er dem, der er mest løst holdt og dermed mest sandsynligt at interagere med andre atomer.
* binding: Kemiske bindinger dannes, når atomer deler eller overfører valenselektroner.
* kovalente obligationer: Atomer deler valenselektroner.
* ioniske bindinger: Et atom overfører en eller flere valenselektroner til et andet atom.
nøglepunkter at huske:
* Antallet af valenselektroner, som et atom har, bestemmer dets bindingsadfærd.
* Atomer har en tendens til at vinde, miste eller dele valenselektroner for at opnå en stabil elektronkonfiguration, typisk med en fuld ydre skal af elektroner (som de ædle gasser).
Fortæl mig, hvis du gerne vil have en mere detaljeret forklaring af nogen af disse koncepter!
Sidste artikelHvad er typiske isolatorer lavet af?
Næste artikelHvilke metaller, der ikke er leder, tillader strøm af elektrisk strøm?
 Varme artikler
Varme artikler
-
 Ny polymer forbedrer effekt af triboelektriske nanogeneratorerFotografier af en fleksibel PVDF-Gn-film efter at den var skrællet af og en PVDF-Gn-baseret TENG. Kredit: Videnskab fremskridt 26. maj 2017:bind. 3, ingen. 5, e1602902, DOI:10.1126/sciadv.1602902
Ny polymer forbedrer effekt af triboelektriske nanogeneratorerFotografier af en fleksibel PVDF-Gn-film efter at den var skrællet af og en PVDF-Gn-baseret TENG. Kredit: Videnskab fremskridt 26. maj 2017:bind. 3, ingen. 5, e1602902, DOI:10.1126/sciadv.1602902 -
 Video:Sådan får kimchi sit kickKredit:The American Chemical Society Kimchi, den fermenterede kålskål, der er elsket i Korea og rundt om i verden, har en signatur skarp, sur tang. Disse unikke smag kommer fra ikke kun salt og k
Video:Sådan får kimchi sit kickKredit:The American Chemical Society Kimchi, den fermenterede kålskål, der er elsket i Korea og rundt om i verden, har en signatur skarp, sur tang. Disse unikke smag kommer fra ikke kun salt og k -
 Højhastigheds FM-AFM og simulering afslører atomistiske opløsningsprocesser af calcit i vand(a) Atomistisk model af calcitoverflade. (b) Opløsningsprocesserne af calcitoverflade i vand observeret med højhastigheds FM-AFM. Det observeres, at trinnet bevæger sig fra nederste højre til øverste
Højhastigheds FM-AFM og simulering afslører atomistiske opløsningsprocesser af calcit i vand(a) Atomistisk model af calcitoverflade. (b) Opløsningsprocesserne af calcitoverflade i vand observeret med højhastigheds FM-AFM. Det observeres, at trinnet bevæger sig fra nederste højre til øverste -
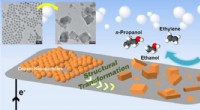 Kobberkatalysator giver højeffektiv CO2-til-brændstofkonverteringSkematisk af en ny katalysator lavet af kobbernanopartikler, der omdanner kuldioxid til multicarbonprodukter (ethylen, ethanol, og propanol). Øverst til venstre er transmissionselektronmikroskopbilled
Kobberkatalysator giver højeffektiv CO2-til-brændstofkonverteringSkematisk af en ny katalysator lavet af kobbernanopartikler, der omdanner kuldioxid til multicarbonprodukter (ethylen, ethanol, og propanol). Øverst til venstre er transmissionselektronmikroskopbilled
- Ved hvilke tre processer opvarmes solen og energien sin atmosfære?
- En billigere måde at udforske fjerne relationer i klimamodeller
- Eksisterer kuglelyn virkelig?
- Kunstigt DNA kan kontrollere frigivelsen af aktive ingredienser fra lægemidler
- Hvis skyld er hungersnød? Hvad verden undlod at lære af 1840'ernes Irland
- Hvad er den bedste ligning for kraft?


