Hvad er forskellen mellem partikler i en fast og gas?
faste stoffer
* Arrangement: Partikler er tæt pakket i et regelmæssigt, gentagne mønster (krystallinsk struktur) eller i en mere tilfældig, mindre organiseret struktur (amorf).
* Bevægelse: Partikler vibrerer i faste positioner. De har lav kinetisk energi.
* afstand: Partikler er meget tæt sammen med lidt plads mellem dem.
* densitet: Faststoffer er tæt på grund af den tætte pakning af partikler.
* form: Faststoffer har en bestemt form og volumen. De modstår ændringer i form og volumen.
Gasser
* Arrangement: Partikler spredes langt fra hinanden og har ingen fast arrangement.
* Bevægelse: Partikler bevæger sig hurtigt og tilfældigt i alle retninger. De har høj kinetisk energi.
* afstand: Partikler er langt fra hinanden med store mellemrum mellem dem.
* densitet: Gasser er mindre tætte end faste stoffer på grund af den store afstand mellem partikler.
* form: Gasser har ingen bestemt form eller volumen. De tager formen og volumenet på deres beholder.
Her er en analogi:
Forestil dig en gruppe mennesker på en overfyldt koncert. De er tæt på hinanden og bevæger sig lidt rundt, men forbliver for det meste på plads. Det er som et solidt.
Forestil dig nu de samme mennesker i et stort, tomt felt. De kan bevæge sig frit i enhver retning, og der er masser af plads mellem dem. Det er som en gas.
Key Takeaway: Den største forskel mellem faste stoffer og gasser ligger i afstand og bevægelse af deres partikler. Dette påvirker direkte deres densitet, form og volumen.
 Varme artikler
Varme artikler
-
 Studie baner vejen for nye lysfølsomme materialerAvisens forfattere, der arbejder i laboratoriet:Lauren Heald, Scott Sayres, Jake Garcia. Kredit:Biodesign Institute ved Arizona State University Fotokatalysatorer er nyttige materialer, med et uta
Studie baner vejen for nye lysfølsomme materialerAvisens forfattere, der arbejder i laboratoriet:Lauren Heald, Scott Sayres, Jake Garcia. Kredit:Biodesign Institute ved Arizona State University Fotokatalysatorer er nyttige materialer, med et uta -
 Ny metode til bekæmpelse af antibiotikaresistens hos mikroberKredit:RUDN Universitet Bakterier i biofilm er 1, 000 gange mere modstandsdygtig over for antibiotika, desinfektionsmidler, mekanisk behandling, og andre former for stress. En kemiker fra RUDN Uni
Ny metode til bekæmpelse af antibiotikaresistens hos mikroberKredit:RUDN Universitet Bakterier i biofilm er 1, 000 gange mere modstandsdygtig over for antibiotika, desinfektionsmidler, mekanisk behandling, og andre former for stress. En kemiker fra RUDN Uni -
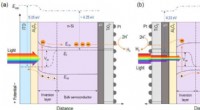 Rumlig afkobling af lysabsorption og reaktionssteder i n-Si fotokatoder til solvandssplitningSkematisk energibåndsdiagram over (a) belysningsreaktion afkoblet n-Si MIS fotokatode og (b) traditionel p-Si MIS fotokatode for HER under belysning. Kredit:Science China Press Solar-drevet fotoel
Rumlig afkobling af lysabsorption og reaktionssteder i n-Si fotokatoder til solvandssplitningSkematisk energibåndsdiagram over (a) belysningsreaktion afkoblet n-Si MIS fotokatode og (b) traditionel p-Si MIS fotokatode for HER under belysning. Kredit:Science China Press Solar-drevet fotoel -
 Ny indsigt i træning af højreaktive kemiske forbindelserDr. Jonas Warneke forklarer kemien bag meget reaktive molekyler, som forskes på Wilhelm Ostwald Instituttet. Kredit:Universität Leipzig Meget reaktive molekyler kan ikke overleve længe i naturen.
Ny indsigt i træning af højreaktive kemiske forbindelserDr. Jonas Warneke forklarer kemien bag meget reaktive molekyler, som forskes på Wilhelm Ostwald Instituttet. Kredit:Universität Leipzig Meget reaktive molekyler kan ikke overleve længe i naturen.
- Hvad er Boseeinstein kondenserer tilstanden af stof?
- Ingeniører høster hjerteenergi til at drive livreddende enheder
- Sådan fungerer Eden-projektet
- Har Jupiter den korteste dag på alle planeter?
- SpaceX afbryder tilgang til rumstation, forsinket levering (opdatering)
- Konvertering af vedvarende råvarer til platin viser uventet adfærd


