Har molekyler i en væske den samme kinetiske energi som gas?
Her er hvorfor:
* kinetisk energi og temperatur: Kinetisk energi er direkte proportional med temperaturen. Dette betyder, at molekyler i samme temperatur i både væsker og gasser har den samme gennemsnitlige kinetiske energi.
* Intermolekylære kræfter: Den vigtigste forskel ligger i styrken af intermolekylære kræfter . Væsker har stærkere intermolekylære kræfter end gasser. Disse kræfter begrænser bevægelsen af flydende molekyler, hvilket får dem til at have lavere kinetisk energi end gasmolekyler ved den samme temperatur.
i enklere termer:
Forestil dig gasmolekyler som små, energiske kugler, der hopper rundt frit. Flydende molekyler er som disse kugler, men de sidder også fast sammen med lim (de intermolekylære kræfter). Selvom de vibrerer og bevæger sig, kan de ikke bevæge sig så frit som gasmolekylerne.
Derfor, mens den gennemsnitlige kinetiske energi af væske- og gasmolekyler ved den samme temperatur er den samme, har de individuelle molekyler i væsken en lavere kinetisk energi på grund af de stærkere intermolekylære kræfter.
 Varme artikler
Varme artikler
-
 Procesmodellering til mere effektiv fremstilling af papirmasse og papirDaniel Ekbåge. Kredit:Karlstad Universitet Integreret kartonfremstilling består af en række enhedsprocesser, der løbende genererer store mængder procesdata. Fremstilling er energikrævende, og vari
Procesmodellering til mere effektiv fremstilling af papirmasse og papirDaniel Ekbåge. Kredit:Karlstad Universitet Integreret kartonfremstilling består af en række enhedsprocesser, der løbende genererer store mængder procesdata. Fremstilling er energikrævende, og vari -
 Den molekylære afbøjning af lysstråling ved hjælp af diamantanKredit:Pixabay/CC0 Public Domain Et internationalt hold ledet af kemikeren Heinz Langhals fra Ludwig-Maximilians Universitaet (LMU) i München er lykkedes med den molekylære afbøjning af lysstrålin
Den molekylære afbøjning af lysstråling ved hjælp af diamantanKredit:Pixabay/CC0 Public Domain Et internationalt hold ledet af kemikeren Heinz Langhals fra Ludwig-Maximilians Universitaet (LMU) i München er lykkedes med den molekylære afbøjning af lysstrålin -
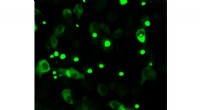 Ny indsigt i Huntingtons sygdomHumane celler, der producerer fluorescens-mærket mutant huntingtin. Muteret huntingtin har en tendens til at akkumulere, hvilket er patologisk og synligt i form af prikker. Kredit:Bremen Universitet
Ny indsigt i Huntingtons sygdomHumane celler, der producerer fluorescens-mærket mutant huntingtin. Muteret huntingtin har en tendens til at akkumulere, hvilket er patologisk og synligt i form af prikker. Kredit:Bremen Universitet -
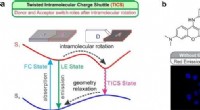 Forskere opdager ny ladningsoverførsel og adskillelsesproces(a) Skematisk illustration af de twisted intramolecular charge shuttle (TICS) mekanismer; D og A betegner elektrondonerende og elektronaccepterende fragmenter, henholdsvis. (b) Reaktionsmekanisme for
Forskere opdager ny ladningsoverførsel og adskillelsesproces(a) Skematisk illustration af de twisted intramolecular charge shuttle (TICS) mekanismer; D og A betegner elektrondonerende og elektronaccepterende fragmenter, henholdsvis. (b) Reaktionsmekanisme for
- Forskere afslører unormal opvarmning i solens øvre atmosfære
- At erstatte BNP med brutto økosystemprodukt afslører værdien af naturen
- 29 gram pulver til ounces?
- Hvordan ændrer evolution den relative hyppighed af alleler i en genpulje, hvorfor dette sker?
- Hvad hedder det største SRAR, vi kender i vores univers?
- En femlags tilgang til sikker genåbning af arbejdspladser


