Hvad er den varme, der kræves for at ændre temperatur på 1 gram et stof?
Her er sammenbruddet:
* Specifik varmekapacitet: Dette er en materiel egenskab, der fortæller dig, hvor meget energi der er nødvendig for at hæve temperaturen på 1 gram af dette stof med 1 graders Celsius (eller 1 Kelvin). Det måles i enheder som joules pr. Gram pr. Grad Celsius (J/g ° C).
* varme: Mængden af energi overført på grund af en temperaturforskel.
Formel:
Varmen (q), der kræves for at ændre temperaturen (ΔT) for et stof med en masse (m) og specifik varmekapacitet (c), kan beregnes ved hjælp af denne formel:
q =m * c * ΔT
Eksempel:
Lad os sige, at du vil beregne den krævede varme for at hæve temperaturen på 1 gram vand fra 20 ° C til 21 ° C. Vandets specifikke varmekapacitet er ca. 4.184 J/g ° C.
* m =1 gram
* C =4.184 J/g ° C
* ΔT =21 ° C - 20 ° C =1 ° C
Tilslutning af disse værdier til formlen:
Q =1 g * 4,184 J/g ° C * 1 ° C =4,184 J
Derfor har du brug for 4.184 joules varme for at hæve temperaturen på 1 gram vand med 1 graders celsius.
Vigtig note: Forskellige stoffer har forskellige specifikke varmekapaciteter. For eksempel har vand en høj specifik varmekapacitet, hvilket betyder, at det kræver en masse energi at ændre dens temperatur. Dette er grunden til, at vand bruges som kølemiddel i mange applikationer.
 Varme artikler
Varme artikler
-
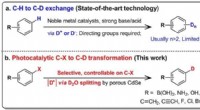 Præcis deuteration ved hjælp af tungt vandFigur viser sammenligningen mellem den konventionelle H/D-udveksling (baseret på CH-bindinger) og den nye tungvandssplittemetode (baseret på C-X-bindinger). Kredit:National University of Singapore
Præcis deuteration ved hjælp af tungt vandFigur viser sammenligningen mellem den konventionelle H/D-udveksling (baseret på CH-bindinger) og den nye tungvandssplittemetode (baseret på C-X-bindinger). Kredit:National University of Singapore -
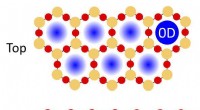 Dækning af metalkatalysatoroverflader med tynde todimensionale oxidmaterialer kan forbedre kemiske …En illustration af fysisk lukkede rum i en porøs dobbeltlags silica film på en metalkatalysator, der kan bruges til kemiske reaktioner. Siliciumatomer er angivet med de orange cirkler; iltatomer ved d
Dækning af metalkatalysatoroverflader med tynde todimensionale oxidmaterialer kan forbedre kemiske …En illustration af fysisk lukkede rum i en porøs dobbeltlags silica film på en metalkatalysator, der kan bruges til kemiske reaktioner. Siliciumatomer er angivet med de orange cirkler; iltatomer ved d -
 Zeolitkatalysatorer baner vejen til decentrale kemiske processerZeolit-katalyse reducerer væsentligt temperatur- og energibehovet i et nøgletrin i den kemiske proces til fremstilling af biobrændstof fra organisk affald. Dr. Yue Liu, Teresa Schachtl og Daniel Melze
Zeolitkatalysatorer baner vejen til decentrale kemiske processerZeolit-katalyse reducerer væsentligt temperatur- og energibehovet i et nøgletrin i den kemiske proces til fremstilling af biobrændstof fra organisk affald. Dr. Yue Liu, Teresa Schachtl og Daniel Melze -
 Holde jordbær friske ved hjælp af bioaktiv emballageKredit:CC0 Public Domain Québec producerer flere jordbær end nogen anden canadisk provins. Jordbær er sarte og svære at holde friske. Som svar på denne udfordring, Monique Lacroix, professor ved I
Holde jordbær friske ved hjælp af bioaktiv emballageKredit:CC0 Public Domain Québec producerer flere jordbær end nogen anden canadisk provins. Jordbær er sarte og svære at holde friske. Som svar på denne udfordring, Monique Lacroix, professor ved I
- Hvordan ville du skelne en videnskabelig teori fra loven?
- Hvad måles kraften over et område?
- Når kolde luftmasser skubber mod varmt, hvad dannes der?
- Forsker studerer, hvordan professionelle sportsfans bruger mobiltelefoner
- Hvorfor er Merkur den varmeste planet?
- Hvordan man laver syntetiske Emeralds


