Hvad er forholdet mellem tryk og smeltepunkt for et stof?
Generelle tendenser:
* De fleste stoffer: For de fleste stoffer fører øget tryk til et øget smeltepunkt . Dette skyldes, at trykket komprimerer molekylerne, hvilket gør det sværere for dem at skifte fra et fast stof til en flydende tilstand. Det øgede tryk "holder" molekylerne effektivt sammen i en solid struktur.
* Vand: Vand er en bemærkelsesværdig undtagelse fra denne generelle tendens. Forøget tryk sænker vandets smeltepunkt , så det kan smelte i væske ved lavere temperaturer. Dette skyldes, at den flydende form for vand er tættere end dens faste form (is), så øget tryk favoriserer den flydende tilstand.
faktorer, der påvirker forholdet:
* densitetsændring ved smeltning: Nøglefaktoren er forskellen i densitet mellem de faste og flydende faser. Hvis det faste stof er tættere, vil stigende tryk favorisere den faste fase og dermed hæve smeltepunktet. Hvis væsken er tættere, vil øget tryk favorisere den flydende fase og dermed sænke smeltepunktet.
* molekylær struktur: Strukturen og bindingen inden for molekylerne påvirker også smeltepunktet og dens respons på tryk.
* specifikt stof: Hvert stof har unikke egenskaber, og forholdet mellem tryk og smeltepunkt skal bestemmes eksperimentelt.
Eksempler:
* kuldioxid: Solid co₂ (tøris) sublimer (går direkte fra fast til gas) ved atmosfærisk tryk. Under højt tryk kan det imidlertid være flydende og derefter til sidst størknes til en tættere form af fast co₂.
* is: Ved atmosfærisk tryk smelter is ved 0 ° C. Men ved højt tryk falder smeltepunktet, og isen smelter ved lavere temperaturer. Dette forklarer, hvordan skøjter fungerer, da det tryk, der påføres af bladet, smelter et tyndt lag is, hvilket reducerer friktion.
Kortfattet:
Mens der er generelle tendenser, er forholdet mellem tryk og smeltepunkt komplekst og specifikt for hvert stof. Det afhænger primært af densitetsforskellen mellem de faste og flydende faser, molekylstrukturen og det specifikke stofs egenskaber.
 Varme artikler
Varme artikler
-
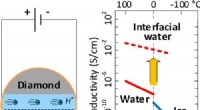 Forskere måler elektrisk ledningsevne af rent grænsefladevandGrafisk abstrakt. Kredit: Journal of Physical Chemistry Letters Skoltech-forskere i samarbejde med forskere fra universitetet i Stuttgart, Karlsruhe Institute of Technology og Russian Quantum Cen
Forskere måler elektrisk ledningsevne af rent grænsefladevandGrafisk abstrakt. Kredit: Journal of Physical Chemistry Letters Skoltech-forskere i samarbejde med forskere fra universitetet i Stuttgart, Karlsruhe Institute of Technology og Russian Quantum Cen -
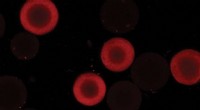 En ny forståelse af proteinbevægelseEt team af ingeniører har vist, at overfladediffusion i proteintransport til ionbytterperler afhænger af adsorptionsaffinitet - et mål for tiltrækning mellem de to materialer. Kredit:University of Del
En ny forståelse af proteinbevægelseEt team af ingeniører har vist, at overfladediffusion i proteintransport til ionbytterperler afhænger af adsorptionsaffinitet - et mål for tiltrækning mellem de to materialer. Kredit:University of Del -
 Stand-up poser fra vedvarende råvarer og nanocelluloseKredit:Technical Research Center of Finland (VTT) VTT Technical Research Center of Finland Ltd har udviklet lette 100% biobaserede stand-up poser med høj teknisk ydeevne. Høj ydeevne i både ilt, f
Stand-up poser fra vedvarende råvarer og nanocelluloseKredit:Technical Research Center of Finland (VTT) VTT Technical Research Center of Finland Ltd har udviklet lette 100% biobaserede stand-up poser med høj teknisk ydeevne. Høj ydeevne i både ilt, f -
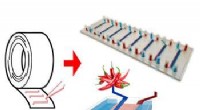 Ved hjælp af almindelig tape, forskere laver chip, der kan fremskynde udviklingen af lægemidlerEt forenklet skema af det tape-baserede barriere-on-a-chip system. Kredit:KTH Kgl. Teknologisk Institut Med almindelig dobbeltklæbende tape, forskere i Sverige samlede en chip-baseret model af en
Ved hjælp af almindelig tape, forskere laver chip, der kan fremskynde udviklingen af lægemidlerEt forenklet skema af det tape-baserede barriere-on-a-chip system. Kredit:KTH Kgl. Teknologisk Institut Med almindelig dobbeltklæbende tape, forskere i Sverige samlede en chip-baseret model af en
- Hvad er forskellen mellem strålende energi og stråling?
- Nordfrankrig var allerede beboet mere end 650, 000 år siden
- Hvorfor en realitystjernes overbevisning sætter så stærk præcedens for hævnporno-ofre overalt
- Risikoen for at træarter forsvinder i det centrale Afrika er en stor bekymring, siger forskere
- Disse bruger lysenergi fra solen til at producere mad?
- Hvad er en stødende klippe med små krystaller kaldet?


