Hvorfor er det termodynamisk muligt for nogle ioniske faste stoffer at opløses, selvom opløsningsprocessen endotermisk?
Her er en sammenbrud:
* gibbs fri energi (ΔG): Denne termodynamiske mængde bestemmer, om en proces er spontan eller ej. En negativ ΔG indikerer en spontan proces, mens en positiv ΔG indikerer en ikke-spontan proces.
* entalpi (ΔH): Dette repræsenterer varmeændringen af en proces. En positiv ΔH betegner en endotermisk proces (varme absorberes), mens en negativ ΔH indikerer en eksoterm proces (varme frigøres).
* entropi (ΔS): Dette måler et systems lidelse eller tilfældighed. Opløsning af et fast stof i en væske fører generelt til en stigning i entropi (mere lidelse).
Ligningen: Forholdet mellem disse mængder er givet af:
ΔG =ΔH - TΔS
hvor:
* T er temperaturen i Kelvin
hvordan opløsning kan være spontan på trods af at være endoterm:
* entropi driver processen: Selvom det kan være endotermisk (positivt ΔH), kan stigningen i entropi (positiv ΔS) være betydelig nok til at overvinde enthalpi -ændringen, hvilket gør den samlede Gibbs -fri energi (ΔG <0). Dette betyder, at processen er spontan.
Eksempel:
Tænk på opløsning af bordsalt (NaCl) i vand. Processen er endotermisk, da den absorberer varme fra omgivelserne. Imidlertid bliver ionerne fra NaCl meget spredt og tilfældigt fordelt i vandet, hvilket fører til en signifikant stigning i entropi. Denne entropi -stigning opvejer den endotermiske enthalpi -ændring, hvilket gør opløsningsprocessen spontan ved stuetemperatur.
Kortfattet:
* Spontaniteten af en proces bestemmes af Gibbs fri energi, ikke kun entalpi.
* Selvom en proces er endotermisk, kan den være spontan, hvis stigningen i entropi er stor nok.
* Opløsning af ioniske faste stoffer fører ofte til en signifikant stigning i entropi på grund af spredningen af ioner i opløsningsmidlet, hvilket gør processen termodynamisk gunstig.
 Varme artikler
Varme artikler
-
 Forskere opdager en ny måde at målrette mod lægemiddelresistente bakterier påMethicillin-resistent Staphylococcus aureus . Kredit:NIH/NIAID John Innes Center-forskere er blandt et internationalt hold, der har opdaget en ny klasse af forbindelser, der målretter mod bakter
Forskere opdager en ny måde at målrette mod lægemiddelresistente bakterier påMethicillin-resistent Staphylococcus aureus . Kredit:NIH/NIAID John Innes Center-forskere er blandt et internationalt hold, der har opdaget en ny klasse af forbindelser, der målretter mod bakter -
 Forståelse og styring af det molekyle, der skabte universetMarcos Dantus, Universitets fremtrædende professor i kemi og fysik, har genskabt interstellare ioner med lasere. Kredit:MSU Trihydrogen, eller H 3 + , er anerkendt af videnskabsmænd som det mo
Forståelse og styring af det molekyle, der skabte universetMarcos Dantus, Universitets fremtrædende professor i kemi og fysik, har genskabt interstellare ioner med lasere. Kredit:MSU Trihydrogen, eller H 3 + , er anerkendt af videnskabsmænd som det mo -
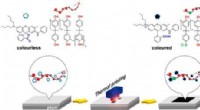 Et skridt i retning af at kvitte register kvitteringer af BPAKredit:American Chemical Society Selvom USA og andre lande har forbudt eller begrænset brugen af bisphenol A (BPA) på grund af miljø- og sundhedsmæssige bekymringer, det bruges stadig i termotry
Et skridt i retning af at kvitte register kvitteringer af BPAKredit:American Chemical Society Selvom USA og andre lande har forbudt eller begrænset brugen af bisphenol A (BPA) på grund af miljø- og sundhedsmæssige bekymringer, det bruges stadig i termotry -
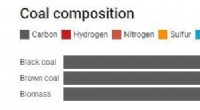 Hvordan laver vi brint af kul, og er det virkelig et rent brændstof?Kredit:Samtalen Energigiganten AGL afslørede i denne uge planer om at producere brintkraft på deres Loy Yang A-kulstation. Men hvordan forvandler vi kul, som ofte opfattes som blot lavet af kulsto
Hvordan laver vi brint af kul, og er det virkelig et rent brændstof?Kredit:Samtalen Energigiganten AGL afslørede i denne uge planer om at producere brintkraft på deres Loy Yang A-kulstation. Men hvordan forvandler vi kul, som ofte opfattes som blot lavet af kulsto
- Hvilket tidspunkt på dagen stiger en ny måne?
- Undersøgelse:Besøgshaven forbedrer fængselsbesøgsoplevelsen for alle
- Hvad er Cumulus Clouds lavet af?
- Ansigt af teenagepige fra 9, 000 år siden rekonstrueret
- Kontinental skorpe -model belyser processer, der fandt sted for tre til fire milliarder år siden
- Hvilket objekt udøver den største tyngdekraft inden for vores solsystem?


