Hvorfor betragtes metaller som ledere?
1. Hav af elektroner:
* struktur: I modsætning til ikke-metaler, hvor elektroner er tæt bundet til individuelle atomer, har metaller et "hav" af delokaliserede elektroner. Disse elektroner er ikke forbundet med noget bestemt atom og er frie til at bevæge sig gennem hele metalstrukturen.
* Mobilitet: Dette hav af elektroner giver mulighed for nem bevægelse af ladning, hvilket gør metaller fremragende ledere af elektricitet.
2. Gratis elektroner:
* Energiniveau: De ydre valenselektroner i metaller er kun svagt bundet til deres atomer. De har høje energiniveau og kan let være glade for højere energitilstande.
* ledning: Når et elektrisk felt påføres, kan disse frie elektroner let bevæge sig som svar på feltet og bære den elektriske strøm.
3. Metallisk binding:
* struktur: Metalliske bindinger opstår fra tiltrækningen mellem positivt ladede metalioner og det omgivende hav af delokaliserede elektroner.
* Konduktivitet: Denne stærke attraktion sikrer, at elektronerne forbliver frit til at bevæge sig, hvilket bidrager til metallers høje ledningsevne.
4. Andre faktorer:
* Temperatur: Mens metaller er fremragende ledere ved stuetemperatur, falder deres ledningsevne, når temperaturen øges. Dette skyldes, at øget termisk energi forårsager flere kollisioner mellem elektroner og ioner og hindrer deres strøm.
Kortfattet: Den frie bevægelse af elektroner i "havet af elektroner" -strukturen af metaller gør dem usædvanligt gode ledere af både elektricitet og varme. Denne egenskab gør dem uvurderlige i mange applikationer, fra elektriske ledninger og elektronik til køleplade og køkkengrej.
 Varme artikler
Varme artikler
-
 Takket være maskinlæring, fremtiden for katalysatorforskning er nu300 kvaternære katalysatorer udtages tilfældigt fra et stort materialerum, hvor deres ydeevne i forhold til OCM systematisk evalueres ved eksperimenter med høj gennemstrømning, efterfulgt af maskinlær
Takket være maskinlæring, fremtiden for katalysatorforskning er nu300 kvaternære katalysatorer udtages tilfældigt fra et stort materialerum, hvor deres ydeevne i forhold til OCM systematisk evalueres ved eksperimenter med høj gennemstrømning, efterfulgt af maskinlær -
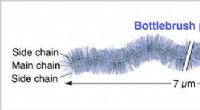 Verdens længste flaskebørstepolymer nogensinde syntetiseretFlaskebørstepolymer er en polymer bestående af en enkelt hovedkæde og adskillige sidekæder podet fra hovedkæden. Kredit:National Institute for Materials Science NIMS og RIKEN er lykkedes med at sy
Verdens længste flaskebørstepolymer nogensinde syntetiseretFlaskebørstepolymer er en polymer bestående af en enkelt hovedkæde og adskillige sidekæder podet fra hovedkæden. Kredit:National Institute for Materials Science NIMS og RIKEN er lykkedes med at sy -
 Høj opløsning, terahertz-drevet atomprobe tomografiIonfeltfordampning udløst af terahertz i en tomografisk atomprobe. (A) Ultrashort terahertz (røde) pulser er fokuseret på en metallisk nanotip inde i et højvakuumkammer. Den højspænding, der påføres d
Høj opløsning, terahertz-drevet atomprobe tomografiIonfeltfordampning udløst af terahertz i en tomografisk atomprobe. (A) Ultrashort terahertz (røde) pulser er fokuseret på en metallisk nanotip inde i et højvakuumkammer. Den højspænding, der påføres d -
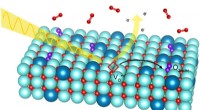 En ny facet af brændselscellekemiRøntgenstråler tillod forskere at se iltgasmolekyler klæbe til en specielt forberedt elektrodeoverflade, et vigtigt skridt i den elektrokemiske reaktion, der finder sted i brændselsceller. Kredit:Abel
En ny facet af brændselscellekemiRøntgenstråler tillod forskere at se iltgasmolekyler klæbe til en specielt forberedt elektrodeoverflade, et vigtigt skridt i den elektrokemiske reaktion, der finder sted i brændselsceller. Kredit:Abel
- Hvordan skriver man hydroxid i en kemisk ligning?
- Hvad er klimaet i Mars?
- Hvad bryder sukker ned for at producere celler energi?
- Kan celle respiration forekomme i organisme ved en temperatur på ca. 65 ° C - give grunde?
- Vandafvisende materiale falder som en slange, når det beskadiges
- Er et pund en del af det metriske system?


