Hvorfor producerer placering af to forskellige metaller i en frugt en elektrisk strøm?
* Elektrokemisk reaktion: Når to forskellige metaller anbringes i en frugt, forekommer en kemisk reaktion ved grænsefladen mellem hvert metal og frugtens sure juice. Denne reaktion involverer overførsel af elektroner mellem metaller og saften, skaber en potentiel forskel eller spænding.
* elektrolyt: Frugtsaft fungerer som en elektrolyt, der giver ioner mulighed for at bevæge sig frit og afslutte kredsløbet. Den sure natur af saften giver de nødvendige ioner til reaktionen.
* Ingen kontinuerlig strømning: Mens der genereres en spænding, er der ingen kontinuerlig strøm af strøm. Elektronerne overføres kun ved metalfrugtgrænsefladen. For at oprette en strøm har du brug for et komplet kredsløb med en belastning, der er forbundet mellem de to metalelektroder.
Kort sagt opretter opsætningen et batteri, hvor frugtsaft fungerer som elektrolytten og metallerne som elektroderne. Den genererede spænding er et resultat af de kemiske reaktioner mellem metaller og saften, ikke en kontinuerlig strøm af strøm.
Her er nogle yderligere punkter:
* Metalvalg: Forskellige metaller skaber forskellige spændinger. For eksempel vil en kobber- og zinkkombination producere en højere spænding end en kobber- og jernkombination.
* frugtsyre: Flere sure frugter producerer højere spændinger.
* citronsaft: Citronsaft bruges ofte til dette eksperiment, fordi den er meget sur.
For at opsummere demonstrerer eksperimentet principperne for elektrokemi, hvor kemiske reaktioner genererer en spænding. Det er en enkel og sjov måde at udforske de grundlæggende koncepter med batterier og elektriske kredsløb på.
Sidste artikelHvordan ændrer du kernen i et atom?
Næste artikelHvad gør fast væske og gas forskellige med hinanden?
 Varme artikler
Varme artikler
-
 Forskere finder, at 2-D overgangsmetalkarbider reagerer med vand, åbner en dør til deres ukendte k…MXenes reaktivitet over for vand er vist i dette eksperiment, hvor en Ti-carbid MXene overlever længere i en iltmættet, ikke-vandigt system, i modsætning til det samme MXene dispergeret i argon-mættet
Forskere finder, at 2-D overgangsmetalkarbider reagerer med vand, åbner en dør til deres ukendte k…MXenes reaktivitet over for vand er vist i dette eksperiment, hvor en Ti-carbid MXene overlever længere i en iltmættet, ikke-vandigt system, i modsætning til det samme MXene dispergeret i argon-mættet -
 Ekstremt effektiv udvinding kan forbedre styringen af atombrændstofEn tetradentatligand vælger americium (Am, afbildet af grønne kugler) over europium (Eu, blå kugler). Rød angiver iltatomer og lilla, nitrogenatomer, der er nøglen til ligandens selektivitet. Kredit:O
Ekstremt effektiv udvinding kan forbedre styringen af atombrændstofEn tetradentatligand vælger americium (Am, afbildet af grønne kugler) over europium (Eu, blå kugler). Rød angiver iltatomer og lilla, nitrogenatomer, der er nøglen til ligandens selektivitet. Kredit:O -
 Ny proces booster lignin bio-olie som næste generations brændstofTræer er en kilde til cellulose, hemicelluloser, og lignin. En ny proces til at opgradere lignin bio-olie til kulbrinter kan hjælpe med at udvide brugen af lignin, som nu stort set er et affaldsprod
Ny proces booster lignin bio-olie som næste generations brændstofTræer er en kilde til cellulose, hemicelluloser, og lignin. En ny proces til at opgradere lignin bio-olie til kulbrinter kan hjælpe med at udvide brugen af lignin, som nu stort set er et affaldsprod -
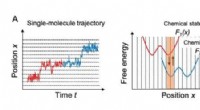 Matematisk modellering afslører, hvordan chitinase, en molekylær monorail, adlyder et envejsskiltFig. 1. (A) Bane for enkeltmolekylær bevægelse og tilsvarende kemisk-tilstandsafhængige frie energiprofiler. (B) Skematisk af en skjult Markov -model, hvor de kemiske tilstande betragtes som skjulte t
Matematisk modellering afslører, hvordan chitinase, en molekylær monorail, adlyder et envejsskiltFig. 1. (A) Bane for enkeltmolekylær bevægelse og tilsvarende kemisk-tilstandsafhængige frie energiprofiler. (B) Skematisk af en skjult Markov -model, hvor de kemiske tilstande betragtes som skjulte t
- Jordskælv i South Napa forbundet med sommerens grundvandsdip
- Hvad er de faktorer, der påvirker mekanisk ligevægtsfysik?
- Hvilke elementer udgør sirup?
- Hvad kaldes det, når mindre og af den oplyste halvmåne kan se hver nat?
- Hvor på et enzymbinding binder substratet til?
- Hvad er 6 decimetre som en almindelig brøkdel ud af 100?


