Hvad gør fast væske og gas forskellige med hinanden?
Her er en sammenbrud:
faste stoffer:
* Partikler: Tæt pakket, arrangeret i et regelmæssigt, gentagende mønster (krystalgitter).
* Bevægelse: Vibrerer i faste positioner med meget lidt bevægelse.
* form: Bestemt form.
* bind: Bestemt volumen.
* Kompressibilitet: Næsten ukomprimerbar.
* Eksempel: Is, sten, metal.
væsker:
* Partikler: Tæt pakket, men kan bevæge sig rundt i hinanden. Intet fast mønster.
* Bevægelse: Flyt frit, konstant skiftende position.
* form: Tager formen på sin beholder.
* bind: Bestemt volumen.
* Kompressibilitet: Lidt komprimerbar.
* Eksempel: Vand, olie, kviksølv.
Gasser:
* Partikler: Vidligere fordelt, bevæge sig tilfældigt og uafhængigt.
* Bevægelse: Høj hastighed, konstant tilfældig bevægelse.
* form: Tager formen på sin beholder.
* bind: Fylder hele beholderen.
* Kompressibilitet: Meget komprimerbar.
* Eksempel: Luft, ilt, kuldioxid.
Kortfattet:
* faste stoffer: Fast form og volumen, lav partikelbevægelse.
* væsker: Ingen fast form, men bestemt volumen, moderat partikelbevægelse.
* Gasser: Ingen fast form eller volumen, høj partikelbevægelse.
temperatur af et stof påvirker dets stof. Tilsætning af varme øger partiklernes kinetiske energi, hvilket får dem til at bevæge sig hurtigere og bryde fri fra deres faste positioner. Denne overgang kan illustreres ved vandcyklussen:
* fast: Is (lav temperatur, partikler vibrerer i faste positioner).
* væske: Vand (medium temperatur, partikler kan bevæge sig rundt om hinanden).
* gas: Vanddamp (høj temperatur, partikler bevæger sig frit).
Bemærk: Der er også tilstande med stof ud over disse tre, såsom plasma og bose-einstein kondensater, men de er uden for denne forklaring.
 Varme artikler
Varme artikler
-
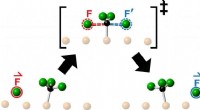 Opdagelsen af knock-on kemi åbner nye grænser inden for reaktionsdynamikEn kunstners fortolkning af den energibarriere, som et reagensfluoratom skal krydse, når det kolliderer med et fluormethylmolekyle på vej til at danne et produkt som følge af en kemisk reaktion. Forsk
Opdagelsen af knock-on kemi åbner nye grænser inden for reaktionsdynamikEn kunstners fortolkning af den energibarriere, som et reagensfluoratom skal krydse, når det kolliderer med et fluormethylmolekyle på vej til at danne et produkt som følge af en kemisk reaktion. Forsk -
 Fremstilling af biologiske lægemidler med edderkoppesilkeproteinSpringende edderkop. Kredit:Lena Holm Forskere ved Karolinska Institutet i Sverige har formået at syntetisere lungeoverfladeaktivt stof, et lægemiddel, der bruges til pleje af premature babyer, ve
Fremstilling af biologiske lægemidler med edderkoppesilkeproteinSpringende edderkop. Kredit:Lena Holm Forskere ved Karolinska Institutet i Sverige har formået at syntetisere lungeoverfladeaktivt stof, et lægemiddel, der bruges til pleje af premature babyer, ve -
 Ny reaktion letter opdagelse af lægemidlerKredit:CC0 Public Domain Kemikere ved ETH Zürich har fundet en let metode, der gør det muligt at omdanne en almindeligt brugt byggesten direkte til andre typer vigtige forbindelser. Dette udvider m
Ny reaktion letter opdagelse af lægemidlerKredit:CC0 Public Domain Kemikere ved ETH Zürich har fundet en let metode, der gør det muligt at omdanne en almindeligt brugt byggesten direkte til andre typer vigtige forbindelser. Dette udvider m -
 Hydrogelbaserede elektroder til hjerneimplantater udvikletPrøve af hydrogel udviklet. Kredit:Kizkitza Gonzalez / UPV / EHU Hydrogeler er fysiske og kemiske polymernetværk, der er i stand til at tilbageholde store mængder væske under vandige forhold uden
Hydrogelbaserede elektroder til hjerneimplantater udvikletPrøve af hydrogel udviklet. Kredit:Kizkitza Gonzalez / UPV / EHU Hydrogeler er fysiske og kemiske polymernetværk, der er i stand til at tilbageholde store mængder væske under vandige forhold uden
- Hvad er de største geologiske træk på Mars?
- BREAD Collaboration søger efter mørke fotoner ved hjælp af en koaksial parabolantenne
- Støvskål ville ødelægge dagens afgrøder, undersøgelse finder
- Hvor mange dråber vand svarer til en væske ounce?
- Størrelsen af en naturbrand i Oregon understreger det store vestlige USA
- Hvad er langt de fleste mineraler?


