Hvilke af disse egenskaber vand kan ikke tilskrives hydrogenbinding mellem molekyler?
egenskaber ved vand, der kan henføres til hydrogenbinding:
* Højt kogepunkt: Hydrogenbindinger kræver betydelig energi til at bryde, hvilket fører til et relativt højt kogepunkt for vand sammenlignet med andre molekyler af lignende størrelse.
* højt smeltepunkt: I lighed med kogepunktet gør stærke brintbindinger det sværere for vandmolekyler at overgang fra fast til væske.
* Høj overfladespænding: Hydrogenbindinger skaber en stærk sammenhængende kraft mellem vandmolekyler, hvilket resulterer i en høj overfladespænding.
* Godt opløsningsmiddel: Polariteten af vandmolekyler på grund af deres evne til at danne brintbindinger gør vand til et fremragende opløsningsmiddel for mange polære stoffer (som salte og sukker).
* Høj varmekapacitet: Vand kan absorbere en stor mængde varme uden en betydelig ændring i temperaturen på grund af den energi, der kræves for at bryde brintbindinger.
ejendom, der ikke kan henføres til hydrogenbinding:
* Gennemsigtighed: Mens hydrogenbinding bidrager til vandets samlede struktur, skyldes vandets gennemsigtighed primært den måde, lys interagerer med de individuelle vandmolekyler. Det handler mere om arrangementet af elektroner inden for molekylet, og hvordan de absorberer/transmitterer lys.
Kortfattet: Hydrogenbinding er den primære kraft bag de fleste af vandets unikke og vigtige egenskaber. Gennemsigtighed er et separat egenskab ved vandmolekyler selv.
Sidste artikelHvad er volumenet af en atombombe?
Næste artikelHvad er problemer forårsaget af udvidelsen af faste stoffer?
 Varme artikler
Varme artikler
-
 Her er et twist til en ældgammel klassiker:Laktosefri chokolademælkTo nordøstlige kandidater har bragt skifer, deres mærke af laktosefri chokolademælk, på hylderne i mere end 300 dagligvarebutikker langs østkysten. Kredit:Matthew Modoono/Northeastern University F
Her er et twist til en ældgammel klassiker:Laktosefri chokolademælkTo nordøstlige kandidater har bragt skifer, deres mærke af laktosefri chokolademælk, på hylderne i mere end 300 dagligvarebutikker langs østkysten. Kredit:Matthew Modoono/Northeastern University F -
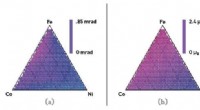 Kombineret datatilgang kan fremskynde udviklingen af nye materialerBilledtekst:(a) Kerr-rotationskortlægning af et jern, kobolt, nikkelkompositspredning ved hjælp af den mere nøjagtige højgennemstrømningsforsøgsmetode, (b) kun høj gennemløbsberegning, og (c) Iwasaki
Kombineret datatilgang kan fremskynde udviklingen af nye materialerBilledtekst:(a) Kerr-rotationskortlægning af et jern, kobolt, nikkelkompositspredning ved hjælp af den mere nøjagtige højgennemstrømningsforsøgsmetode, (b) kun høj gennemløbsberegning, og (c) Iwasaki -
 At få terapeutiske lydbølger gennem tykke kranierEn version af det keramiske kraniumimplantat udviklet af et UC Riverside-ledet team af forskere. Kredit:David Baillot, Jacobs School of Engineering Ultralyds hjernekirurgi har et enormt potentiale
At få terapeutiske lydbølger gennem tykke kranierEn version af det keramiske kraniumimplantat udviklet af et UC Riverside-ledet team af forskere. Kredit:David Baillot, Jacobs School of Engineering Ultralyds hjernekirurgi har et enormt potentiale -
 Slikker en Tootsie Roll -sensor for at overvåge sundhedEn elektrode fremstillet med en støbt Tootsie Roll og aluminiumsrør kan hjælpe med at overvåge ægløsningstilstand og nyresundhed. Kredit:Tilpasset fra ACS Applied Materials &Interfaces 2021 Engang
Slikker en Tootsie Roll -sensor for at overvåge sundhedEn elektrode fremstillet med en støbt Tootsie Roll og aluminiumsrør kan hjælpe med at overvåge ægløsningstilstand og nyresundhed. Kredit:Tilpasset fra ACS Applied Materials &Interfaces 2021 Engang
- Forskellige dele af en globe
- Flere spiralformede magnetiske bløde robotter bringer os tættere på at forstå kollektiv adfærd
- En lov kun for Trumps præsidentskab? Californiens foranstaltning har til formål at beskytte staten…
- Vandigt kaliumhydroxid med svovldioxid?
- Hvordan er videnskaben en undersøgelsesproces?
- Hvorfor udsender jorden længere bølgestråling end sol?


