Hvordan er tætheden og temperaturen i luft relateret?
* Ideel gaslov: Forholdet mellem densitet, temperatur og tryk på en gas styres af den ideelle gaslov:
* pv =nrt
hvor:
* P =tryk
* V =volumen
* n =antal mol gas
* R =ideel gaskonstant
* T =temperatur (i Kelvin)
* densitet og temperatur: Densitet (ρ) er defineret som masse (m) pr. Enhedsvolumen (v):
* ρ =m/v
* relateret densitet og temperatur: Vi kan omarrangere den ideelle gaslov for at udtrykke densitet med hensyn til temperatur:
* ρ =(nm)/rt (hvor m er den molære luftmasse)
* Denne ligning viser, at densiteten er omvendt proportional med temperatur Når trykket og antallet af mol er konstant.
i enklere termer:
* Højere temperatur: Når luft bliver varmere, bevæger molekylerne sig hurtigere og spreder sig, hvilket resulterer i en lavere densitet.
* lavere temperatur: Når luft bliver koldere, bremser molekylerne og bevæger sig tættere sammen, hvilket fører til en højere densitet.
Eksempel: Varm luft stiger, fordi den er mindre tæt end den omgivende køligere luft. Derfor flyder varmluftsballoner, og hvorfor tordenvejr udvikler sig.
Yderligere faktorer:
* tryk: Presset spiller også en rolle. Højere tryk kan komprimere luft, hvilket fører til højere densitet, selv ved en given temperatur.
* Fugtighed: Tilstedeværelsen af vanddamp kan påvirke lufttætheden. Fugtig luft er mindre tæt end tør luft ved den samme temperatur, fordi vanddampmolekyler er lettere end nitrogen- og iltmolekyler.
Kortfattet: Luftens temperatur og tæthed er omvendt relateret. Når temperaturen øges, falder densiteten, og vice versa. Dette forhold er vigtigt for at forstå forskellige atmosfæriske fænomener som konvektion og vejrmønstre.
Sidste artikelForklar, hvordan ustabile atomer får stabilitet?
Næste artikelHvad definerer anden lov om termodynamik?
 Varme artikler
Varme artikler
-
 Ny undersøgelse præsenterer højaktive ozygenerede grupper i kulstofmaterialer til oxygenreduktion…Figur 1. Ydeevnekarakteriseringerne af ORHP. Kredit:Professor Jong-Beom Baek, UNIST Hydrogenperoxid (H 2 O 2 ) har fundet mange anvendelser i den moderne industri, herunder at fungere som en g
Ny undersøgelse præsenterer højaktive ozygenerede grupper i kulstofmaterialer til oxygenreduktion…Figur 1. Ydeevnekarakteriseringerne af ORHP. Kredit:Professor Jong-Beom Baek, UNIST Hydrogenperoxid (H 2 O 2 ) har fundet mange anvendelser i den moderne industri, herunder at fungere som en g -
 Revneformering er asymmetrisk i polære materialerKredit:Catalan Institute of Nanoscience and Nanotechnology ICN2 Oxide Nanophysics Group, ledet af ICREA prof. Gustau Catalán, har udgivet i Fysiske anmeldelsesbreve hvordan, på grund af flexoele
Revneformering er asymmetrisk i polære materialerKredit:Catalan Institute of Nanoscience and Nanotechnology ICN2 Oxide Nanophysics Group, ledet af ICREA prof. Gustau Catalán, har udgivet i Fysiske anmeldelsesbreve hvordan, på grund af flexoele -
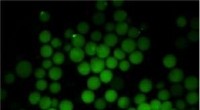 Små geler opsuger intestinale toksinerMikrogeler er vist ovenfor med sukkermotiver efter binding fluorescensmærkede lektiner. Kredit:Alexander Kuehne Bakterielle infektioner, der er målrettet mod tarmen, kan forårsage tilstande, der s
Små geler opsuger intestinale toksinerMikrogeler er vist ovenfor med sukkermotiver efter binding fluorescensmærkede lektiner. Kredit:Alexander Kuehne Bakterielle infektioner, der er målrettet mod tarmen, kan forårsage tilstande, der s -
 En ny måde at modulere farveemissioner fra gennemsigtige filmEn ny undersøgelse fra Japan giver frisk indsigt i skabelsen af mere effektive flerfarvede transparente selvlysende materialer. Kredit:Tokyo University of Science Forskere ser på selvlysende gen
En ny måde at modulere farveemissioner fra gennemsigtige filmEn ny undersøgelse fra Japan giver frisk indsigt i skabelsen af mere effektive flerfarvede transparente selvlysende materialer. Kredit:Tokyo University of Science Forskere ser på selvlysende gen


