Hvorfor reagerer et knust faste stoffer med gas hurtigere end stor del af det samme faste stof?
* overfladeareal og reaktionshastighed: Kemiske reaktioner forekommer, når molekyler af reaktanterne kommer i kontakt. Jo mere overfladeareal et fast stof har, jo flere kontaktpunkter tilbyder det for gasmolekyler at interagere med.
* knust fast stof: Når et fast stof knuses, bryder det ind i mindre stykker, hvilket dramatisk øger det samlede overfladeareal udsat. Dette betyder, at der er flere muligheder for gasmolekyler til at kollidere med det faste og reagere.
* stor del: En stor del har et relativt lille overfladeareal sammenlignet med dets volumen. Det meste af det faste stof er utilgængeligt for gasmolekylerne, hvilket begrænser reaktionshastigheden.
Eksempel:
Forestil dig en isblok. Hvis du forlader det i et rum, smelter det langsomt, da luftmolekylerne kommer i kontakt med dens overflade. Men hvis du knuser isen i små stykker, øges overfladearealet markant. Nu kan luftmolekylerne interagere med isen meget lettere, hvilket får den til at smelte meget hurtigere.
Kortfattet:
Det øgede overfladeareal af et knust fast stof giver flere muligheder for gasmolekyler til at kollidere og reagere, hvilket fører til en hurtigere reaktionshastighed.
 Varme artikler
Varme artikler
-
 Genbrug af plastik:Vinylpolymer nedbrudt til aspirinkomponenterDer går ikke en dag uden nyheder om mikroplastik i vores have. Der er ikke mange effektive metoder til genanvendelse af plast uden at gå på kompromis med kvaliteten. Et fyrtårn af håb blev for nylig t
Genbrug af plastik:Vinylpolymer nedbrudt til aspirinkomponenterDer går ikke en dag uden nyheder om mikroplastik i vores have. Der er ikke mange effektive metoder til genanvendelse af plast uden at gå på kompromis med kvaliteten. Et fyrtårn af håb blev for nylig t -
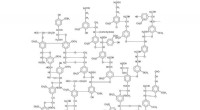 Dominerende svamp kunne være løsningen til at producere flere biobrændstoffer og kemikalierEt eksempel på en mulig ligninstruktur. Kredit:GFDL ver. 1.2 eller CC-by-sa ver. 2,5, 2.0, og 1.0 lub Public Domain (PD) Opdagelsen af et nyt enzym, der frigiver et værdifuldt kemikalie fra land
Dominerende svamp kunne være løsningen til at producere flere biobrændstoffer og kemikalierEt eksempel på en mulig ligninstruktur. Kredit:GFDL ver. 1.2 eller CC-by-sa ver. 2,5, 2.0, og 1.0 lub Public Domain (PD) Opdagelsen af et nyt enzym, der frigiver et værdifuldt kemikalie fra land -
 Forskere bruger nanoteknologi til at øge ydeevnen af vigtige industrielle katalysatorerDenne farvede transmissionselektronmikroskopi af ultratynd film af ceria afslører, at individuelle atomer (vist som prikker) skifter under intens tryk. Kredit:Sang Chul Lee En lille smule klem ell
Forskere bruger nanoteknologi til at øge ydeevnen af vigtige industrielle katalysatorerDenne farvede transmissionselektronmikroskopi af ultratynd film af ceria afslører, at individuelle atomer (vist som prikker) skifter under intens tryk. Kredit:Sang Chul Lee En lille smule klem ell -
 Forskere genskaber parfume fra det 17. århundrede af Constantijn HuygensEn krukke med ingredienserne til parfumen. Kredit:Leiden University Et team af forskere fra Young Academy og Huygens ING/NL Lab har bragt en tre århundreder gammel duft til live baseret på en opskr
Forskere genskaber parfume fra det 17. århundrede af Constantijn HuygensEn krukke med ingredienserne til parfumen. Kredit:Leiden University Et team af forskere fra Young Academy og Huygens ING/NL Lab har bragt en tre århundreder gammel duft til live baseret på en opskr
- Uber til at øge sin baggrundskontrol for drivere
- Undersøgelse:Netværksmodel for implicitte mål for holdninger
- T-Rex fossil sælges for rekordstore $31,8 mio
- Fremstilling af fleksibel elektronik med nanowire-netværk
- SMOS og Swarm slår sig sammen for at få øje på en kæmpe solstorm
- Metallurgi:Studiet af metaller og deres egenskaber


