Hvorfor har forskellige forbindelser forskellige farver i deres synlige emission?
1. Elektronisk struktur:
* Energiniveau: Elektroner i atomer og molekyler findes ved specifikke energiniveau. Når en forbindelse absorberer energi (som fra varme eller lys), kan elektroner hoppe til højere energiniveau.
* ophidset tilstand: Den ophidsede tilstand er ustabil, og elektronet falder hurtigt tilbage til sit oprindelige energiniveau.
* Emission: Når elektronet falder tilbage, frigiver det den absorberede energi som lys. Farven på dette udsendte lys afhænger af energiforskellen mellem den ophidsede tilstand og jordtilstanden.
2. Farve og energi:
* Synligt spektrum: Det synlige lysspektrum spænder fra Violet (højeste energi) til rød (laveste energi).
* specifikke energiovergange: Forskellige forbindelser har forskellige elektroniske strukturer, hvilket fører til forskellige energiniveauafstand. Dette betyder, at energiforskellen mellem de ophidsede og jordtilstande vil være unik for hver forbindelse.
* Farveemission: Det udsendte lys svarer til energiforskellen. Forbindelser med mindre energiforskelle vil udsende rødt lys, mens de med større energiforskelle vil udsende violet lys.
3. Andre faktorer:
* molekylær struktur: Arrangementet af atomer og bindinger inden for et molekyle påvirker dens elektroniske struktur og energiniveau.
* Kemisk miljø: Det omgivende miljø, som opløsningsmiddel eller temperatur, kan også påvirke energiniveauet og farven på det udsendte lys.
Kortfattet: Farven på en sammensætnings synlige emission bestemmes af de specifikke energiovergange, som dens elektroner gennemgår, når de er begejstrede af lys. Disse overgange dikteres af forbindelsens unikke elektroniske struktur, påvirket af dens molekylstruktur og kemiske miljø.
Eksempel:
* natrium (NA) i en flammetest: Natriumatomer absorberer energi fra flammen, hvilket får elektroner til at hoppe til højere energiniveau. Når de vender tilbage til jordtilstanden, udsender de gult lys, der er karakteristisk for natrium.
Dette er en forenklet forklaring, og der er mere komplekse aspekter at overveje, såsom fluorescens og fosforescens. Imidlertid giver denne forklaring en grundlæggende forståelse af, hvorfor forskellige forbindelser udsender forskellige lysfarver.
Sidste artikelHvad er massetalet af reaktanter fission og fusion?
Næste artikelHvad er tre måder, et atom kan få stabilitet på?
 Varme artikler
Varme artikler
-
 Forskere undersøger materialeegenskaber for længerevarende, mere effektive solcellerTidligere postdoktor ved Florida State University, Sarah Wieghold, venstre, og FSU adjunkt i kemi og biokemi Lea Nienhaus. Deres forskning hjælper med at forstå de grundlæggende processer i et materia
Forskere undersøger materialeegenskaber for længerevarende, mere effektive solcellerTidligere postdoktor ved Florida State University, Sarah Wieghold, venstre, og FSU adjunkt i kemi og biokemi Lea Nienhaus. Deres forskning hjælper med at forstå de grundlæggende processer i et materia -
 Forskere optrævler mysterierne om irreversibilitet i elektrokrome tynde filmSmarte vinduer, en af de mest lovende anvendelser af wolframoxid (WO3) tynde film, er transmissionskontrollerbare vinduer, der bruges i biler, fly, og bygningsapplikationer. Kredit:Joel Filipe fra S
Forskere optrævler mysterierne om irreversibilitet i elektrokrome tynde filmSmarte vinduer, en af de mest lovende anvendelser af wolframoxid (WO3) tynde film, er transmissionskontrollerbare vinduer, der bruges i biler, fly, og bygningsapplikationer. Kredit:Joel Filipe fra S -
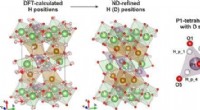 Forskere afslører kompleks defekt struktur af Li-ion katode materialeGrafisk abstrakt. Kredit: Uorganisk kemi (2021). DOI:10.1021/acs.inorgchem.0c03241 Skoltech-forskere har undersøgt hydroxyl-defekterne i LiFePO 4 , et meget udbredt katodemateriale i kommerciel
Forskere afslører kompleks defekt struktur af Li-ion katode materialeGrafisk abstrakt. Kredit: Uorganisk kemi (2021). DOI:10.1021/acs.inorgchem.0c03241 Skoltech-forskere har undersøgt hydroxyl-defekterne i LiFePO 4 , et meget udbredt katodemateriale i kommerciel -
 I eksperimenter på Jorden, afprøve mulige byggesten i fremmed livat udsætte kunstige aminosyrer for ekstreme forhold, forskere jagter efter spor om, hvad der skal til for at overleve på andre planeter. Kredit:Claire Mammoser, Valparaiso Universitet Forskere for
I eksperimenter på Jorden, afprøve mulige byggesten i fremmed livat udsætte kunstige aminosyrer for ekstreme forhold, forskere jagter efter spor om, hvad der skal til for at overleve på andre planeter. Kredit:Claire Mammoser, Valparaiso Universitet Forskere for
- Hvad skete der med energi, når et apparater bruges i længere tid?
- Lennon eller McCartney? Kan statistisk analyse løse et forfatterskabspuslespil?
- Hvilken familie er klor?
- Hvorfor øges surhedsgraden efter ilt i mælk er blevet brugt op?
- Eye
- Hvilken lov siger, at kraft afhænger af massen og accelerationen af et objekt?


