Hvor mange elektroner kan svovl låne?
Her er hvorfor:
* Svovls elektronkonfiguration: Svovl har 6 elektroner i sin ydre skal. Det har brug for 2 flere elektroner for at opnå en stabil oktet.
* kovalent binding: I stedet for at vinde elektroner direkte, danner svovl kovalente bindinger med andre atomer. Dette involverer deling af elektroner for at opnå en stabil oktet.
Derfor er svovl ikke "lånt" elektroner. Det deler dem i kovalente obligationer.
For eksempel danner svovl i et svovldioxid (SO2) molekyle to dobbeltbindinger med iltatomer, der deler to elektroner med hvert iltatom.
Sidste artikelHvordan er elektroner karakteriseret?
Næste artikelHvilket stof gør huden vandafstående?
 Varme artikler
Varme artikler
-
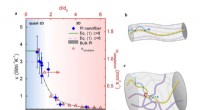 Tilfældig gang mellem varmebærere i amorfe polymerer(a) Diameterafhængigheden af termisk ledningsevne af polyimid -nanofibre. Romben repræsenterer eksperimentdata. Der er en dimensionel crossover af varmediffusion i molekylære kæder fra quasi-1D til
Tilfældig gang mellem varmebærere i amorfe polymerer(a) Diameterafhængigheden af termisk ledningsevne af polyimid -nanofibre. Romben repræsenterer eksperimentdata. Der er en dimensionel crossover af varmediffusion i molekylære kæder fra quasi-1D til -
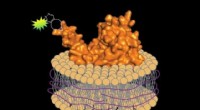 En platform til at forberede fluorescensmærkede proteiner og simulere deres native miljøVed at bruge en vaskemiddelfri metode, biologer kan fremstille fluorescens-mærkede proteiner sammen med et lille segment af den associerede cellemembran, bevare proteinets native miljø. Kredit:Jean-Ma
En platform til at forberede fluorescensmærkede proteiner og simulere deres native miljøVed at bruge en vaskemiddelfri metode, biologer kan fremstille fluorescens-mærkede proteiner sammen med et lille segment af den associerede cellemembran, bevare proteinets native miljø. Kredit:Jean-Ma -
 Side-by-side afsætning af atomisk flade halvlederplader forbedrer solcellekonverteringseffektivitet…Solenergikonvertering ved hjælp af en lateral WSe2-MoS2 heterojunction. Kredit:© 2017 WILEY VCH Supertynde fotovoltaiske enheder understøtter solteknologien, og der søges derfor meget efter gevins
Side-by-side afsætning af atomisk flade halvlederplader forbedrer solcellekonverteringseffektivitet…Solenergikonvertering ved hjælp af en lateral WSe2-MoS2 heterojunction. Kredit:© 2017 WILEY VCH Supertynde fotovoltaiske enheder understøtter solteknologien, og der søges derfor meget efter gevins -
 Ny metode muliggør effektiv prøveforberedelse til enkeltcellet proteomikKredit:Kumamoto University Proteinerne, der udgør vores celler, rummer en hel verden af information, som, når de er låst op, kan give os indsigt i oprindelsen af mange væsentlige biologiske fæn
Ny metode muliggør effektiv prøveforberedelse til enkeltcellet proteomikKredit:Kumamoto University Proteinerne, der udgør vores celler, rummer en hel verden af information, som, når de er låst op, kan give os indsigt i oprindelsen af mange væsentlige biologiske fæn
- Tuningstrategier og struktureffekter af elektrokatalysatorer til kuldioxidreduktionsreaktionen
- Hvor forekommer medikamentmetabolisme?
- Værktøjsstioptimering gør hurtig værktøjsservobearbejdning med nanometerpræcision mulig
- Hvordan skriver du 0,062 i videnskabelig notation?
- Foldede 2D-materialer har egenskaber, der er nyttige til kvantekommunikation
- Spin flipper opad protoner


