Indeholder elementer med elektroner i S P D og F orbitaler?
Her er sammenbruddet:
* s orbitaler: Dette er de laveste energi -orbitaler og fyldes altid først. Hvert element har elektroner i s orbitaler.
* p orbitaler: Disse orbitaler er højere i energi end S -orbitaler og udfyldes efter S -orbitaler. Alle elementer fra bor (B) og fremefter har elektroner i P -orbitaler.
* d orbitaler: Disse er endnu højere i energi end P -orbitaler og er fyldt efter S og P orbitaler. Alle elementer fra Scandium (SC) og fremefter har elektroner i D -orbitaler.
* f orbitaler: Dette er de højeste i energi og er fyldt efter S-, P- og D -orbitaler. Alle elementer fra lanthanum (LA) og fremefter har elektroner i f orbitaler.
Derfor vil ethvert element med et atomnummer større end eller lig med lanthanum (LA) have elektroner i alle fire typer orbitaler (S, P, D og F).
Eksempler:
* lanthanum (LA): [XE] 5D¹ 6S²
* guld (AU): [Xe] 4f¹⁴ 5d¹⁰ 6s¹
* uran (U): [RN] 5f³ 6D¹ 7S²
Fortæl mig, hvis du gerne vil have mere specifikke eksempler eller forklaringer!
Sidste artikelHvad er Positron -udslettelsesspektroskopi?
Næste artikelHvilken af atomteorien er ikke acceptabel af videnskaben?
 Varme artikler
Varme artikler
-
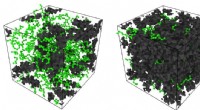 Tæt mellemrum spids tilstedeværelse af petrokemikalierSimuleringssnapshots af Rice University-ingeniører viser n-heptan-molekyler (grøn) under forskellige grader af indeslutning i en polymermatrix af molekyler (sort), hvor den højviskose polymer er en mo
Tæt mellemrum spids tilstedeværelse af petrokemikalierSimuleringssnapshots af Rice University-ingeniører viser n-heptan-molekyler (grøn) under forskellige grader af indeslutning i en polymermatrix af molekyler (sort), hvor den højviskose polymer er en mo -
 Neutroner afslører den vilde Weyl-verden af halvmetallerWeyl-semimetalltilstanden induceres, når elektronernes modsatte bevægelser får Dirac-keglerne til at dele sig i to (illustreret til venstre af udadvendte elektroner, modsat de indadvendte elektroner t
Neutroner afslører den vilde Weyl-verden af halvmetallerWeyl-semimetalltilstanden induceres, når elektronernes modsatte bevægelser får Dirac-keglerne til at dele sig i to (illustreret til venstre af udadvendte elektroner, modsat de indadvendte elektroner t -
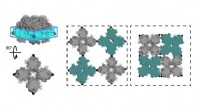 Supercomputer fremkomsten af materiel adfærdKemikere ved University of California, San Diego (UCSD) designet et ark proteiner (C98RhuA), der skifter mellem forskellige porøsitetstilstande og densitet. Cellerne i krystalgitteret er hængslet i hj
Supercomputer fremkomsten af materiel adfærdKemikere ved University of California, San Diego (UCSD) designet et ark proteiner (C98RhuA), der skifter mellem forskellige porøsitetstilstande og densitet. Cellerne i krystalgitteret er hængslet i hj -
 CO2-neutral brint fra biomasseKredit:Vienna University of Technology Uden fossile brændstoffer, der kan ikke være nogen højovnsproces – men brint kan spille en vigtigere rolle i fremtiden. En miljøvenlig proces er ved at blive
CO2-neutral brint fra biomasseKredit:Vienna University of Technology Uden fossile brændstoffer, der kan ikke være nogen højovnsproces – men brint kan spille en vigtigere rolle i fremtiden. En miljøvenlig proces er ved at blive
- Hvad er den afbalancerede ligning for cobalt III nitrat og lithiumhydroxid?
- Ny tilgang til at forudsige egenskaber af uopdagede kerner og grænsen til nuklear landskab
- Hvad er fugtige vinde fra Mexicogolfen og arktisk?
- Sådan rundes til den understregede stedværdiposition
- Hvilken slags celle har en kerne omgivet af sin egen membran og andre indre dele afgrænsede membran…
- Hvilken effekt har en stigning i regn på et kaparral økosystem?


