Hvad er en måde at fremskynde en kemisk reaktion ud over at tilføje enzymer?
Her er hvorfor:
* Kollisionsteori: Kemiske reaktioner forekommer, når molekyler kolliderer med nok energi til at bryde eksisterende bindinger og danne nye.
* Temperatur og energi: Forøgelse af temperaturen øger den gennemsnitlige kinetiske energi af molekyler. Dette betyder, at de bevæger sig hurtigere og kolliderer hyppigere med større kraft, hvilket øger chancerne for vellykkede kollisioner, der fører til en reaktion.
Det er dog vigtigt at bemærke:
* Temperaturgrænser: Mens stigende temperatur generelt fremskynder reaktionerne, er der grænser. Ekstremt høje temperaturer kan få molekyler til at nedbrydes eller nedbrydes, hvilket hindrer reaktionen.
* specificitet: Temperatureffekter kan variere afhængigt af den specifikke reaktion. Nogle reaktioner er mere følsomme over for temperaturændringer end andre.
Fortæl mig, hvis du gerne vil udforske andre måder at fremskynde kemiske reaktioner på!
Sidste artikelHvad er opløseligheden af N-methylanilin?
Næste artikelI lysreaktionen, hvad er elektrondonor Hvor ender elektroner?
 Varme artikler
Varme artikler
-
 Video:Hvordan kinin forårsagede Første VerdenskrigHvis vi ser på, hvordan cinchonatræets bark bruges til at behandle malaria, kan vi se den banebrydende kemi af kinin, der binder et enzym, der er afgørende for malariaparasittens overlevelse. Men hvis
Video:Hvordan kinin forårsagede Første VerdenskrigHvis vi ser på, hvordan cinchonatræets bark bruges til at behandle malaria, kan vi se den banebrydende kemi af kinin, der binder et enzym, der er afgørende for malariaparasittens overlevelse. Men hvis -
 Teknologi gør smartphones til on-the-spot detektorer for fødevarebårne sygdomme, andre farlige fo…Purdue teknologi, inklusive en smartphone-holder, gør telefoner til on-the-spot detektorer for fødevarebårne sygdomme. Kredit:Purdue University Purdue University forskere har udviklet detektionste
Teknologi gør smartphones til on-the-spot detektorer for fødevarebårne sygdomme, andre farlige fo…Purdue teknologi, inklusive en smartphone-holder, gør telefoner til on-the-spot detektorer for fødevarebårne sygdomme. Kredit:Purdue University Purdue University forskere har udviklet detektionste -
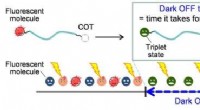 Når FRETING over cancerbiomarkører ikke virker, fokusere på at blinke i stedet forSkematisk repræsentation af fluorescensblink styret af tripletdannelse og triplet-triplet energioverførsel. Kredit:Osaka University Fluorescensspektroskopi er uundværlig i biomedicinsk diagnostik.
Når FRETING over cancerbiomarkører ikke virker, fokusere på at blinke i stedet forSkematisk repræsentation af fluorescensblink styret af tripletdannelse og triplet-triplet energioverførsel. Kredit:Osaka University Fluorescensspektroskopi er uundværlig i biomedicinsk diagnostik. -
 Dobbeltemulsioner i skummetmælk ved hjælp af minimale fødevarekvalitetsemulgatorer til fedtfattig…Forskere producerer fedtfattig cheddar, der smager ligesom de rigtige ting. Kredit:Steven Lilley/Flickr For mange af os, en ostefad efter et godt måltid er en skyldig fornøjelse. Men ny forskning
Dobbeltemulsioner i skummetmælk ved hjælp af minimale fødevarekvalitetsemulgatorer til fedtfattig…Forskere producerer fedtfattig cheddar, der smager ligesom de rigtige ting. Kredit:Steven Lilley/Flickr For mange af os, en ostefad efter et godt måltid er en skyldig fornøjelse. Men ny forskning


