Hvordan danner atomer i molekylære forbindelser stabile elektronarrangementer?
1. Octet -reglen:
- De fleste atomer stræber efter at have en fuld ydre skal af elektroner, der normalt indeholder otte elektroner (oktetreglen).
- Undtagelser inkluderer brint og helium, som kun har brug for to elektroner for at fylde deres ydre skal.
- At have en fuld ydre skal giver stabilitet og minimerer reaktivitet.
2. Deling af elektroner:
- Atomer opnår denne stabile konfiguration ved at dele deres valenselektroner (elektroner i den yderste skal).
- Disse delte elektroner danner en kovalent binding, der holder atomerne sammen i et molekyle.
3. Typer af kovalente obligationer:
- enkelt obligation: Et par elektroner deles mellem to atomer.
- dobbelt obligation: To par elektroner deles.
- Triple Bond: Tre par elektroner deles.
4. Eksempler:
- vand (H₂O): Oxygen har 6 valenselektroner og har brug for 2 mere for at afslutte sin oktet. Hvert hydrogenatom har 1 valenselektron og har brug for 1 mere. Oxygen deler et elektron med hvert hydrogenatom, der danner to enkeltbindinger.
- kuldioxid (co₂): Carbon har 4 valenselektroner og har brug for 4 mere. Oxygen har 6 valenselektroner og har brug for 2 mere. Kulstof danner to dobbeltbindinger med hvert iltatom, der deler to elektroner med hvert ilt.
5. Lewis Structures:
- Lewis -strukturer er en enkel måde at repræsentere kovalente bindinger og elektronarrangementer på. De bruger prikker til at repræsentere valenselektroner og linjer til at repræsentere delte elektronpar (obligationer).
6. Polære kovalente bindinger:
- Nogle gange deles elektronerne i en kovalent binding ikke lige mellem atomerne.
- Dette sker, når det ene atom er mere elektronegativt (tiltrækker elektroner stærkere) end den anden.
- Dette resulterer i en polær binding, hvor den ene ende af bindingen har en lidt negativ ladning, og den anden ende har en lidt positiv ladning.
Kortfattet:
- Atomer i molekylære forbindelser danner stabile elektronarrangementer ved at dele deres valenselektroner gennem kovalente bindinger.
- Denne deling giver atomer mulighed for at opnå en fuld ydre skal af elektroner, hvilket giver stabilitet og minimerer reaktivitet.
- Den type kovalent binding (enkelt, dobbelt eller tredobbelt) afhænger af antallet af elektroner, der deles mellem atomerne.
- Elektronegativitetsforskellen mellem atomer kan føre til polære kovalente bindinger, hvor den ene ende af bindingen er lidt positiv, og den anden er lidt negativ.
 Varme artikler
Varme artikler
-
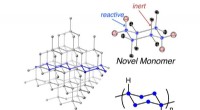 Ny polymer inspireret af krystallinsk silicium til at bygge bedre computere og solcellerAt finde nye måder at lave bedre materialer til elektroniske kredsløb på er en måde at lave en bedre enhed. En ny polymer, kaldet poly (cyclosilane) (nederst til højre), er i det væsentlige en ultra-l
Ny polymer inspireret af krystallinsk silicium til at bygge bedre computere og solcellerAt finde nye måder at lave bedre materialer til elektroniske kredsløb på er en måde at lave en bedre enhed. En ny polymer, kaldet poly (cyclosilane) (nederst til højre), er i det væsentlige en ultra-l -
 Forskere udvikler en ny måde at skabe et spektrum af naturligt udseende hårfarverForskere kan opnå et arrangement af farver ved at ændre koncentrationen af melanin. Kredit:Northwestern University Vi har længe været advaret om farerne ved at farve hår derhjemme og i saloner.
Forskere udvikler en ny måde at skabe et spektrum af naturligt udseende hårfarverForskere kan opnå et arrangement af farver ved at ændre koncentrationen af melanin. Kredit:Northwestern University Vi har længe været advaret om farerne ved at farve hår derhjemme og i saloner. -
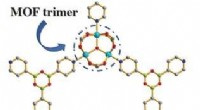 Meget resorptive metal-organiske rammerKredit:Angewandte Chemie International Edition Gasser og forurenende stoffer kan filtreres fra luft og væsker ved hjælp af porøse, krystallinske materialer, såsom metal-organiske rammer (MOFer). F
Meget resorptive metal-organiske rammerKredit:Angewandte Chemie International Edition Gasser og forurenende stoffer kan filtreres fra luft og væsker ved hjælp af porøse, krystallinske materialer, såsom metal-organiske rammer (MOFer). F -
 Bakterielle enzymer:Europiums biologiske rollePå billedet er den største fumarole (La Bocca Grande) i Solfatara-krateret vist, hvor den REE-afhængige bakterie Methylacidiphilum fumariolicum SolV først blev opdaget. Kredit:Huub Op den Camp Rar
Bakterielle enzymer:Europiums biologiske rollePå billedet er den største fumarole (La Bocca Grande) i Solfatara-krateret vist, hvor den REE-afhængige bakterie Methylacidiphilum fumariolicum SolV først blev opdaget. Kredit:Huub Op den Camp Rar
- Forskere fuldfører den første britiske undersøgelse af syntetiske kemikalier fundet i fødevarer
- Hvilken organelle tjener som kontrolcenter for cellemetabolisme og reproduktion?
- 6 metoder til at adskille mineraler fra hinanden?
- Sådan lærer delfiner at arbejde sammen om belønninger
- Hvad er stråler på månen?
- Poolklorstyrke sammenlignet med husholdningsblegemiddel


