Hvilke vandmolekyler er polære med hvad?
* ilt er mere elektronegativ end brint: Dette betyder, at ilt har et stærkere træk på de delte elektroner i de kovalente bindinger mellem ilt og brint.
* bøjet molekylær form: De to hydrogenatomer er ikke direkte overfor iltatomet. Dette skaber en bøjet form med iltatomet ved "peak" og hydrogenatomerne ved "basen."
Denne ujævne fordeling af elektroner og bøjet form resulterer i:
* delvis negativ ladning på iltatomet: Oxygenatomet har en større andel af elektronerne, hvilket giver det en let negativ ladning (Δ-).
* Delvis positive ladninger på brintatomerne: Hydrogenatomerne har en mindre andel af elektronerne, hvilket giver dem en let positiv ladning (Δ+).
Dette skaber et dipolmoment i vandmolekylet med en negativ ende (ilt) og en positiv ende (brint). Det er denne polaritet, der gør vand til et så unikt og vigtigt molekyle.
 Varme artikler
Varme artikler
-
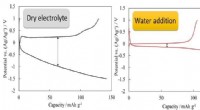 Elektrolyttens struktur styrer batteriets ydeevneVi har fundet ud af, at tilsætning af vand i høj grad reducerer forskellen i spænding (overspænding) mellem opladning/afladning. Kredit:COPYRIGHT (C) TOYOHASHI UNIVERSITY OF TECHNOLOGY. Forskerhol
Elektrolyttens struktur styrer batteriets ydeevneVi har fundet ud af, at tilsætning af vand i høj grad reducerer forskellen i spænding (overspænding) mellem opladning/afladning. Kredit:COPYRIGHT (C) TOYOHASHI UNIVERSITY OF TECHNOLOGY. Forskerhol -
 Hydrogel-komposit udviklet til at hjælpe beskyttelsesudstyr med hurtigt at nedbryde giftige nervest…Kredit:Pixabay/CC0 Public Domain Forskere ved Northwestern University i Evanston, Illinois har udviklet en hydrogel integreret med zirconium-baserede robuste metal-organiske rammer (MOFer), der hu
Hydrogel-komposit udviklet til at hjælpe beskyttelsesudstyr med hurtigt at nedbryde giftige nervest…Kredit:Pixabay/CC0 Public Domain Forskere ved Northwestern University i Evanston, Illinois har udviklet en hydrogel integreret med zirconium-baserede robuste metal-organiske rammer (MOFer), der hu -
 Forskere opdager metode til at kontrollere kræftfremkaldende formaldehydfrigivelse fra træ i hjemm…Kredit:Unsplash/CC0 Public Domain Ny forskning, ledet i fællesskab af University of Massachusetts Amherst og University of North Texas, fremmer vores forståelse af, hvordan træet i vores hjem og ko
Forskere opdager metode til at kontrollere kræftfremkaldende formaldehydfrigivelse fra træ i hjemm…Kredit:Unsplash/CC0 Public Domain Ny forskning, ledet i fællesskab af University of Massachusetts Amherst og University of North Texas, fremmer vores forståelse af, hvordan træet i vores hjem og ko -
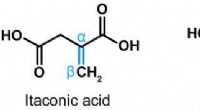 Cellebeskyttelse, immunmodulering og virushæmning af et endogent stofStrukturer af isomererne af itaconsyre. Kredit:CC-BY F. Chen et al. Det endogene molekyle itaconsyre har antivirale og antiinflammatoriske virkninger, som forskere fra TWINCORE for nylig har vist.
Cellebeskyttelse, immunmodulering og virushæmning af et endogent stofStrukturer af isomererne af itaconsyre. Kredit:CC-BY F. Chen et al. Det endogene molekyle itaconsyre har antivirale og antiinflammatoriske virkninger, som forskere fra TWINCORE for nylig har vist.


