Hvornår når en kemisk reaktion ligevægt?
Her er en mere detaljeret forklaring:
* dynamisk ligevægt: Ligevægt er en dynamisk proces, hvilket betyder, at de fremadrettede og omvendte reaktioner stadig sker, lige i samme hastighed. Det er ikke sådan, at reaktionerne stopper, men snarere at de når en balance.
* konstante koncentrationer: Ved ligevægt ændres koncentrationerne af reaktanter og produkter ikke længere. Dette betyder ikke, at koncentrationerne nødvendigvis er ens; Det betyder bare, at de har nået et stabilt punkt.
* reversible reaktioner: Ligevægt er kun mulig for reversible reaktioner, hvor produkterne kan reagere for at danne reaktanterne igen.
Faktorer, der påvirker ligevægt:
* Temperatur: Ændring af temperaturen kan flytte ligevægtspositionen.
* tryk: Ændringer i tryk påvirker ligevægten af gasfase-reaktioner.
* Koncentration: Tilføjelse eller fjernelse af reaktanter eller produkter kan flytte ligevægten.
Betydningen af ligevægt:
Ligevægt er et grundlæggende koncept inden for kemi og spiller en afgørende rolle i mange processer, herunder:
* opløselighed: Opløsningen af salte i vand når et ligevægtspunkt.
* syre-base-reaktioner: Ioniseringen af syrer og baser når ligevægt.
* Biokemiske reaktioner: Mange biokemiske reaktioner i vores kroppe fungerer i ligevægt.
Fortæl mig, hvis du har flere spørgsmål!
Sidste artikelHvor ville du finde produkter og reaktanter i en kemisk formel?
Næste artikelHvilke stoffer diffunderer let gennem membranen?
 Varme artikler
Varme artikler
-
 Det tidløse, komplementær smag af østers og champagne - forklaretKredit:CC0 Public Domain Matchende priser er ikke den eneste grund til, at østers og champagne passer så godt sammen. Det viser en undersøgelse offentliggjort af Københavns Universitet i dag. en u
Det tidløse, komplementær smag af østers og champagne - forklaretKredit:CC0 Public Domain Matchende priser er ikke den eneste grund til, at østers og champagne passer så godt sammen. Det viser en undersøgelse offentliggjort af Københavns Universitet i dag. en u -
 Anvendelse af beregningskemi til at simulere realistiske kemiske processerKredit:University of California - San Diego Videnskabens vand er mudret i disse dage - især ved University of California San Diego, hvor alt, der adskiller en kemiker fra en fysiker, i nogle tilfæ
Anvendelse af beregningskemi til at simulere realistiske kemiske processerKredit:University of California - San Diego Videnskabens vand er mudret i disse dage - især ved University of California San Diego, hvor alt, der adskiller en kemiker fra en fysiker, i nogle tilfæ -
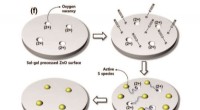 Realisering af farvefilterfri billedsensorerSkematisk mekanisme for S-doping af sol-gel-behandlet ZnO-film. Spin-coated thiocyanation (SCN?) omdannes til aktive S arter ved varmebehandling og migreres til ilt ledige steder ved elektrostatisk kr
Realisering af farvefilterfri billedsensorerSkematisk mekanisme for S-doping af sol-gel-behandlet ZnO-film. Spin-coated thiocyanation (SCN?) omdannes til aktive S arter ved varmebehandling og migreres til ilt ledige steder ved elektrostatisk kr -
 San Antonio-forskere søger at forhindre luft- og rumfartsfejl og katastrofer med olieudslipProfessor Troconis vil studere brintskørhed på molekylært niveau for at se, hvordan brintatomernes placering påvirker metalmaterialets integritet under de høje tryk og forhøjede temperaturer, der er t
San Antonio-forskere søger at forhindre luft- og rumfartsfejl og katastrofer med olieudslipProfessor Troconis vil studere brintskørhed på molekylært niveau for at se, hvordan brintatomernes placering påvirker metalmaterialets integritet under de høje tryk og forhøjede temperaturer, der er t
- Hvad kaldes materialer med lav modstand?
- Hvad bestemmer retningsrødderne vokser?
- Hvad gør en natriumhydrogencarbonatindikator?
- Coronavirus-effekter skader grundskoleelever og nyuddannede, siger ekspert
- Hvordan stamceller fungerer
- Hvis væskens temperatur falder til 10 grader, ville Celsius alle have en tilsvarende ændring i vis…


