Hvad er osmolariteten på 0,4 m ammonium3 PO4 Forklar hvordan?
Forståelse af osmolaritet
* osmolaritet er et mål for den samlede koncentration af opløste partikler i en opløsning. Det udtrykkes i osmoles pr. Liter (OSM/L).
* en osmole Repræsenterer 6,022 x 10²³ partikler (Avogadro's nummer) af et opløst stof.
Beregning af osmolaritet
1. dissociation: Ammoniumphosphat dissocierer i opløsning som følger:
(NH₄) ₃po₄ → 3 NH₄⁺ + PO₄³⁻
2. Antal ioner: Dette betyder, at hver mol af (NH₄) ₃po₄ producerer 4 mol ioner (3 mol NH₄⁺ og 1 mol Po₄³⁻).
3. Osmolaritetsberegning:
* molaritet (m) =0,4 m
* Antal ioner pr. Formelenhed =4
* osmolaritet =molaritet x Antal ioner
* osmolaritet =0,4 m x 4 =1,6 OSM/L
Derfor er osmolariteten af en 0,4 m ammoniumphosphatopløsning 1,6 OSM/L.
Sidste artikelDen type reaktion, hvormed proteiner syntetiseres?
Næste artikelHvor forekommer de lette uafhængige reaktioner?
 Varme artikler
Varme artikler
-
 Kemikere syntetiserer millioner af proteiner, der ikke findes i naturenZachary P. Gates (til venstre) og Brad Pentelute med deres ætsning af Xenoprotein. Kredit:Rachael Fuller MIT-kemikere har udtænkt en måde til hurtigt at syntetisere og screene millioner af nye pro
Kemikere syntetiserer millioner af proteiner, der ikke findes i naturenZachary P. Gates (til venstre) og Brad Pentelute med deres ætsning af Xenoprotein. Kredit:Rachael Fuller MIT-kemikere har udtænkt en måde til hurtigt at syntetisere og screene millioner af nye pro -
 Røntgenstråler afslører en skjult egenskab, der fører til fejl i et lithium-ion batterimaterialeDe lithium-ion-batterier, der almindeligvis bruges til at drive elektriske busser og ledningsfrit værktøj og støvsugere, består ofte af milliarder af nanopartikler af lithiumjernfosfat, batterimateria
Røntgenstråler afslører en skjult egenskab, der fører til fejl i et lithium-ion batterimaterialeDe lithium-ion-batterier, der almindeligvis bruges til at drive elektriske busser og ledningsfrit værktøj og støvsugere, består ofte af milliarder af nanopartikler af lithiumjernfosfat, batterimateria -
 Et katalytisk støttemateriale spiller en ledende rolleArgonne-kemikere har afsløret en vigtig og uventet reaktionsmekanisme - kaldet redox-adfærd - på overfladen af katalysatorbærematerialer. Disse materialer er lovende katalytiske materialer i sig sel
Et katalytisk støttemateriale spiller en ledende rolleArgonne-kemikere har afsløret en vigtig og uventet reaktionsmekanisme - kaldet redox-adfærd - på overfladen af katalysatorbærematerialer. Disse materialer er lovende katalytiske materialer i sig sel -
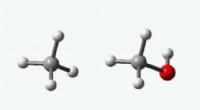 UNTs moderne alkymist tager de første skridt mod at omdanne metan til methanolMetan (til venstre) består af et kulstofatom omgivet af fire brintatomer. Methanol (til højre) ligner metan, men har et oxygenatom mellem et af hydrogenatomerne og carbonatomet. Kredit:UNT At find
UNTs moderne alkymist tager de første skridt mod at omdanne metan til methanolMetan (til venstre) består af et kulstofatom omgivet af fire brintatomer. Methanol (til højre) ligner metan, men har et oxygenatom mellem et af hydrogenatomerne og carbonatomet. Kredit:UNT At find
- Lavprismembran renser lette og tunge olier i et enkelt trin
- Hvad indeholder mere varmeenergi?
- Hvad er den kemiske formel for ammoniumperiodat?
- Hastigheden af en elektromagnetisk bølge er lig med det produkt, dens bølgelængde og dets?
- Kan hacke, men ikke skyde? FBI kan lette adgangen for cyberagenter
- Sorte elever er uforholdsmæssigt disciplineret med suspenderinger og tilbageholdelser i folkeskolen


