Er ikke-polære molekyler mere tiltrukket af andre eller polære molekyler?
* Intermolekylære kræfter: De kræfter, der holder molekyler sammen, kaldes intermolekylære kræfter. Ikke-polære molekyler interagerer primært gennem svage London-spredningskræfter, der opstår som følge af midlertidige udsving i elektronfordeling. Polære molekyler har på den anden side stærkere dipol-dipolinteraktioner og undertiden brintbinding.
* opløselighed: "Som opløser som" er en god tommelfingerregel. Ikke-polære molekyler opløses bedre i ikke-polære opløsningsmidler, mens polære molekyler opløses bedre i polære opløsningsmidler. Dette skyldes, at de intermolekylære kræfter mellem lignende molekyler er stærkere, hvilket muliggør bedre blanding.
Eksempel:
* olie og vand: Olie er ikke-polær, og vand er polær. De blander ikke godt, fordi de stærke brintbindinger i vand ikke let forstyrres af de svage London -spredningskræfter i olie.
Kortfattet: Ikke-polære molekyler tiltrækkes af andre ikke-polære molekyler på grund af de svagere, men stadig til stede, London-spredningskræfter.
 Varme artikler
Varme artikler
-
 Malarias hemmelighed for at overleve i det afdækkede blodBilleder, der viser hæmkrystallisering. Det venstre billede viser normal krystallisation, og det højre viser dette i fravær af PV5 -proteinet. Kredit:Francis Crick Institute Ny forskning fra Franc
Malarias hemmelighed for at overleve i det afdækkede blodBilleder, der viser hæmkrystallisering. Det venstre billede viser normal krystallisation, og det højre viser dette i fravær af PV5 -proteinet. Kredit:Francis Crick Institute Ny forskning fra Franc -
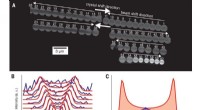 En måde at bestemme den absolutte stereokemi af små, organiske molekylerDiffraktionsdataindsamling og avanceret diffraktionsintensitetsekstraktion. (A) Scanning af krystal under dataindsamling. Stråle- og krystalforskydninger er angivet med hvide pile. (B) Plot af vippeku
En måde at bestemme den absolutte stereokemi af små, organiske molekylerDiffraktionsdataindsamling og avanceret diffraktionsintensitetsekstraktion. (A) Scanning af krystal under dataindsamling. Stråle- og krystalforskydninger er angivet med hvide pile. (B) Plot af vippeku -
 På jagt efter stabile væskerDette kort er baseret på et Copernicus Sentinel-2-billede erhvervet den 11. august 2020 og giver en analyse af det seneste olieudslip i Mauritius. I juli, et olieskib gik på grund på koralrevet ud for
På jagt efter stabile væskerDette kort er baseret på et Copernicus Sentinel-2-billede erhvervet den 11. august 2020 og giver en analyse af det seneste olieudslip i Mauritius. I juli, et olieskib gik på grund på koralrevet ud for -
 Forskere gør vanadium til en nyttig katalysator til hydrogeneringArgonne -kemiker Max Delferro har udviklet en usædvanlig aktiv form for vanadium til hydrogeneringsreaktioner. Vanadium er et billigt almindeligt metal, der kan erstatte nogle af de ædle metaller, der
Forskere gør vanadium til en nyttig katalysator til hydrogeneringArgonne -kemiker Max Delferro har udviklet en usædvanlig aktiv form for vanadium til hydrogeneringsreaktioner. Vanadium er et billigt almindeligt metal, der kan erstatte nogle af de ædle metaller, der
- Ultratynde sejl kunne fremskynde rejsen til andre stjernesystemer
- Virkningerne af at skære træer på økosystemet
- Grønnere medicinalindustrien
- Galaksen i det tidlige univers indeholder trods alt kulstof
- Hvilket kendetegn ved kulstof C gør det vigtigt for levende organismer?
- Har Ganymede klipper, og har det snavs eller grus?


