Brug kollisionsteori til at forklare, hvorfor reaktioner skal forekomme langsommere ved lavere temperaturer?
lavere temperatur =langsommere reaktionshastighed
* lavere energi: Ved lavere temperaturer har molekyler mindre kinetisk energi. Dette betyder, at færre kollisioner vil have den krævede aktiveringsenergi til at bryde eksisterende obligationer og danne nye. Tænk på det som at have brug for en bestemt mængde energi for at skubbe en sten over en bakke - hvis du ikke har nok, bevæger Boulder sig ikke.
* mindre hyppige kollisioner: Lavere temperaturer betyder, at molekyler bevæger sig langsommere. Langsomere bevægelse fører til færre kollisioner mellem reaktantmolekyler generelt.
Kortfattet: Lavere temperaturer fører til et fald i både hyppigheden af kollisioner og antallet af kollisioner, der har tilstrækkelig energi til at overvinde aktiveringsenergibarrieren, hvilket bremser reaktionshastigheden.
Lad os visualisere dette:
Forestil dig to reaktanter, A og B, i en container.
* Høj temperatur: Reaktantmolekyler hopper hurtigt rundt, kolliderer ofte med hinanden, og mange af disse kollisioner har nok energi til at overvinde aktiveringsenergien. Dette fører til en hurtig reaktionshastighed.
* Lav temperatur: Molekyler bevæger sig langsomt, kolliderer mindre ofte, og færre af disse kollisioner har den nødvendige energi til at overvinde aktiveringsenergibarrieren. Dette resulterer i en langsommere reaktionshastighed.
 Varme artikler
Varme artikler
-
 Nær-infrarøde reflekterende blandingsbelægninger har bedre optisk og køleydelseKredit:DOI:10.1016/j.solener.2021.06.061 Kinesiske forskere fandt for nylig, at en nær-infrarød reflekterende blandingscoating havde bedre optisk og køleydelse, derved reducerer den absorberede en
Nær-infrarøde reflekterende blandingsbelægninger har bedre optisk og køleydelseKredit:DOI:10.1016/j.solener.2021.06.061 Kinesiske forskere fandt for nylig, at en nær-infrarød reflekterende blandingscoating havde bedre optisk og køleydelse, derved reducerer den absorberede en -
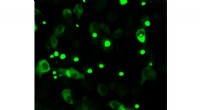 Ny indsigt i Huntingtons sygdomHumane celler, der producerer fluorescens-mærket mutant huntingtin. Muteret huntingtin har en tendens til at akkumulere, hvilket er patologisk og synligt i form af prikker. Kredit:Bremen Universitet
Ny indsigt i Huntingtons sygdomHumane celler, der producerer fluorescens-mærket mutant huntingtin. Muteret huntingtin har en tendens til at akkumulere, hvilket er patologisk og synligt i form af prikker. Kredit:Bremen Universitet -
 Direkte syntese af azulen fortsætter med at afsløre lokkende egenskaberDen blå farve er svær at observere i sin krystalform. Azulene udsender en lugt, der ligner mølkugler. Kredit:Shinshu University Azulen er et ret pænt stof. Som navnet antyder, det viser en ejendom
Direkte syntese af azulen fortsætter med at afsløre lokkende egenskaberDen blå farve er svær at observere i sin krystalform. Azulene udsender en lugt, der ligner mølkugler. Kredit:Shinshu University Azulen er et ret pænt stof. Som navnet antyder, det viser en ejendom -
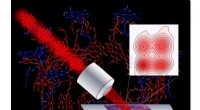 Forskere udvikler mikroskop til at spore lysenergistrøm i fotosyntetiske cellerAnvender en række ultrakorte laserpulser, et nyt mikroskop afslører indviklede detaljer, der styrer fotosyntetiske processer i lilla bakterier. Kredit:Vivek Tiwari, Yassel Acosta og Jennifer Ogilvie
Forskere udvikler mikroskop til at spore lysenergistrøm i fotosyntetiske cellerAnvender en række ultrakorte laserpulser, et nyt mikroskop afslører indviklede detaljer, der styrer fotosyntetiske processer i lilla bakterier. Kredit:Vivek Tiwari, Yassel Acosta og Jennifer Ogilvie
- Er nukleinsyrer tegninger til proteiner?
- Påvirker varmeenergi miljøet?
- Hvad er opløseligheden af en sukkerkrystall?
- Forskere skaber længe søgte zigzag-kantede carbon nanobånd
- Hvad sker der med en lyshastighed, når den passerer fra vandluft?
- Nanoconfinement-konceptet forbedrer sikkerheden af diagnostisk kontrastmiddel


