Hvorfor er to ikke -polære stoffer i stand til at opløses i hinanden?
* ikke -polære molekyler: Disse molekyler har en jævn fordeling af elektroner, hvilket betyder, at de mangler en betydelig positiv eller negativ ladning. De danner ikke stærke attraktioner med polære molekyler.
* Intermolekylære kræfter: Ikke -polære molekyler interagerer hovedsageligt gennem svage London -spredningskræfter. Disse kræfter stammer fra midlertidige udsving i elektronfordeling, hvilket fører til flygtige dipoler.
* opløselighed: Når to ikke -polære stoffer samles, er deres svage London -spredningskræfter tilstrækkelige til at overvinde de kræfter, der holder dem i deres separate faser. Dette giver dem mulighed for at blande og opløses i hinanden.
Eksempel: Olie og fedt er ikke -polære stoffer. De opløses i hinanden, fordi deres svage London -spredningskræfter er stærke nok til at overvinde deres egne sammenhængende kræfter.
I modsætning:
* polære molekyler: Disse molekyler har en ujævn fordeling af elektroner, hvilket skaber delvis positive og negative ladninger. De danner stærke attraktioner med andre polære molekyler gennem dipol-dipolinteraktioner eller hydrogenbinding.
* ublandbarhed: Polære og ikke -polære stoffer blandes generelt ikke. De stærke kræfter mellem polære molekyler overvindes ikke let af de svage kræfter mellem polære og ikke -polære molekyler. Dette resulterer i adskillelse i forskellige faser.
Key Takeaway: Princippet om "som opløser som" understreger, at stoffer med lignende intermolekylære kræfter har en tendens til at være opløselige i hinanden.
 Varme artikler
Varme artikler
-
 Ikke-invasiv mikroskopi detekterer aktiveringstilstand og skelner mellem celletyperMetoder til at udtrække funktioner fra mærkefri immuncelleanalyse. Multivariat etiketfri data, sammensat af både morfologiske og spektrale parametre, bruges til at identificere funktioner på højt nive
Ikke-invasiv mikroskopi detekterer aktiveringstilstand og skelner mellem celletyperMetoder til at udtrække funktioner fra mærkefri immuncelleanalyse. Multivariat etiketfri data, sammensat af både morfologiske og spektrale parametre, bruges til at identificere funktioner på højt nive -
 Forudsig kaos ved hjælp af aerosoler og AIVed at bruge aerosolpartiklernes bevægelse gennem et system i flux, forskere fra McKelvey School of Engineering ved Washington University i St. Louis har udtænkt en ny model, baseret på en deep learni
Forudsig kaos ved hjælp af aerosoler og AIVed at bruge aerosolpartiklernes bevægelse gennem et system i flux, forskere fra McKelvey School of Engineering ved Washington University i St. Louis har udtænkt en ny model, baseret på en deep learni -
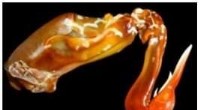 Mantis-rejeklubbens mangefacetterede design er inspirerende avancerede kompositmaterialer til fly, f…Et tværsnit af mantis-rejeklubben viser den stribede region, der var karakteriseret af UCR-forskere. Denne region består af en unik struktur, der vikler sig rundt om køllen for at beskytte den mod sel
Mantis-rejeklubbens mangefacetterede design er inspirerende avancerede kompositmaterialer til fly, f…Et tværsnit af mantis-rejeklubben viser den stribede region, der var karakteriseret af UCR-forskere. Denne region består af en unik struktur, der vikler sig rundt om køllen for at beskytte den mod sel -
 Omdanne cirkler til firkanter:Forskere omkonfigurerer materialetopologi på mikroskalaenForskere kodede mønstre og design ind i materialet ved at lave små, usynlige justeringer af geometrien af det trekantede gitter. Kredit:Shucong Li/Bolei Deng/Harvard SEAS Rekonfigurerbare materi
Omdanne cirkler til firkanter:Forskere omkonfigurerer materialetopologi på mikroskalaenForskere kodede mønstre og design ind i materialet ved at lave små, usynlige justeringer af geometrien af det trekantede gitter. Kredit:Shucong Li/Bolei Deng/Harvard SEAS Rekonfigurerbare materi
- Klimaændringer og brandhæmning
- Hvad ville der ske, hvis solsystemet ikke havde nogen sol?
- Hvilken af baserne findes i RNA?
- Amerikansk energikolonialisme en nøgleårsag til Puerto Rico-orkanen Maria-krisen
- Holder omkostningerne ved superledende magneter nede ved hjælp af ultralyd
- Hvad sker der, hvis energi overføres?


