Hvordan kan diffusionen af molekyler accelereres?
1. Stigende temperatur:
* Højere temperatur betyder mere kinetisk energi: Molekyler bevæger sig hurtigere ved højere temperaturer, hvilket fører til hyppigere kollisioner og hurtigere diffusion.
2. Stigende koncentrationsgradient:
* stejlere gradient =hurtigere diffusion: Jo større forskellen i koncentration mellem to områder, jo hurtigere molekyler bevæger sig fra området med høj koncentration til området med lav koncentration.
3. Faldende størrelse af molekyler:
* mindre molekyler diffunderer hurtigere: Mindre molekyler har mindre modstand mod bevægelse, så de lettere kan navigere gennem rum.
4. Stigende overfladeareal:
* mere overfladeareal betyder flere steder for molekyler at krydse: Et større overfladeareal giver flere muligheder for molekyler til at interagere med det omgivende miljø og diffuse.
5. Faldende viskositet af mediet:
* mindre tyktflydende medium =lettere bevægelse: Et mindre tyktflydende medium (som vand) tilbyder mindre modstand mod bevægelse, hvilket gør det muligt for molekyler at diffundere hurtigere.
6. Omrøring eller agitation:
* Mekanisk blanding Accelererer diffusion: Ved fysisk at blande molekylerne forstyrrer vi koncentrationsgradienten og tvinger molekyler til at sprede sig hurtigere.
7. Brug af en trykgradient:
* skubbe molekyler med: Oprettelse af en trykforskel kan skubbe molekyler fra et højtryksområde til et lavtryksområde, der accelererer diffusion.
8. Brug af en membran med selektiv permeabilitet:
* letter diffusion: Nogle membraner tillader visse molekyler at passere gennem lettere end andre. Denne selektive permeabilitet kan fremskynde diffusionen af specifikke molekyler.
9. Brug af et bærermolekyle:
* Aktiv transport: I nogle tilfælde kan specialiserede molekyler binde til målmolekylerne og lette deres bevægelse over en membran, selv mod en koncentrationsgradient. Denne proces kaldes lettet diffusion.
10. Brug af elektrostatiske interaktioner:
* tiltrækker og afviser: I nogle tilfælde kan molekyler tiltrækkes eller afvises af elektriske ladninger, hvilket kan påvirke deres diffusionshastighed.
Det er vigtigt at bemærke, at de specifikke metoder, der bruges til at fremskynde diffusion, afhænger af den specifikke situation og de involverede molekyler.
Sidste artikelHvorfor er to ikke -polære stoffer i stand til at opløses i hinanden?
Næste artikelHvorfor bruges olie i mikroskopi?
 Varme artikler
Varme artikler
-
 Bioinformatik-computerprogrammer hjælper biologer med at forstå iboende forstyrrede proteinerEt protein med uordnede områder vist med rødt og nummereret. De uordnede områder er langt mere fleksible end de blå, strukturerede regioner. Kredit:Virginia Commonwealth University Proteiner er li
Bioinformatik-computerprogrammer hjælper biologer med at forstå iboende forstyrrede proteinerEt protein med uordnede områder vist med rødt og nummereret. De uordnede områder er langt mere fleksible end de blå, strukturerede regioner. Kredit:Virginia Commonwealth University Proteiner er li -
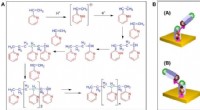 Oprettelse af en chiral polymer ud fra achirale monomerer ved hjælp af et magnetfeltSkematisk og en foreslået mekanisme for elektropolymerisationsprocessen af 2-vinylpyridin. (A) Skematisk over elektropolymerisationsprocessen af 2-vinylpyridin (25). (B) Skematisk af en foreslået
Oprettelse af en chiral polymer ud fra achirale monomerer ved hjælp af et magnetfeltSkematisk og en foreslået mekanisme for elektropolymerisationsprocessen af 2-vinylpyridin. (A) Skematisk over elektropolymerisationsprocessen af 2-vinylpyridin (25). (B) Skematisk af en foreslået -
 Divalent guldkompleks isoleret for første gang i ren formGuld i sin divalente form er stabilt i midten af porfyriner. Kredit:Katja Heinze, JGU Ifølge lærebogsviden, de sædvanlige oxidationstilstande for guld i forbindelser er +I og +III. Den divalente
Divalent guldkompleks isoleret for første gang i ren formGuld i sin divalente form er stabilt i midten af porfyriner. Kredit:Katja Heinze, JGU Ifølge lærebogsviden, de sædvanlige oxidationstilstande for guld i forbindelser er +I og +III. Den divalente -
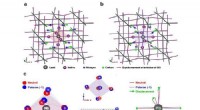 Skinner lys over spændingstilstande i perovskitmaterialerTeoretisk forudsagte strukturer af MAPbI 3 hybrid perovskit:en neutral klynge. b negativt ladet (polaron) klynge. c Forskellige perspektivlige sammenligninger af den neutrale (røde sfære) og polaron
Skinner lys over spændingstilstande i perovskitmaterialerTeoretisk forudsagte strukturer af MAPbI 3 hybrid perovskit:en neutral klynge. b negativt ladet (polaron) klynge. c Forskellige perspektivlige sammenligninger af den neutrale (røde sfære) og polaron
- Hvordan NASA -ingeniører sørger over et rumskibs død
- Hvilken mælk er bedst for miljøet? Vi sammenlignede mejeri, nød, soja, hamp og kornmælk
- Kan kerneenergi fungere godt med anden form for energi?
- Akademikere bekymrer sig om, at de er rovdyrlige,
- Hvorfor skinner månen og planeterne?
- Hvilken grundlæggende naturkraft er ansvarlig for at holde dig på jordoverfladen?


