Hvorfor er vand et alsidigt opløsningsmiddel?
1. Polaritet:
* Hydrogenbinding: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (brintatomer) og et lidt negativt afslutning (iltatom). Denne polaritet giver dem mulighed for at danne stærke brintbindinger med andre polære molekyler.
* evne til at opløse polære opløste stoffer: Denne hydrogenbinding giver vand mulighed for let at opløse mange polære stoffer, såsom sukker, salte og syrer ved at danne stærke interaktioner med deres polære grupper.
2. Høj dielektrisk konstant:
* svækkelse af elektrostatiske interaktioner: Vands høje dielektriske konstant svækker de elektrostatiske interaktioner mellem ioner i opløsning, hvilket gør det muligt for dem at adskille og opløses lettere.
3. Samhørighed og vedhæftning:
* overfladespænding: Vandmolekyler er meget sammenhængende, hvilket betyder, at de holder sig til hinanden på grund af hydrogenbinding. Dette fører til overfladespænding, så det kan danne dråber.
* Adhæsion: Vand klæber også til andre polære overflader, hvilket bidrager til dets evne til at opløse og transportere stoffer.
4. Temperaturstabilitet:
* Høj varmekapacitet: Vand har en høj varmekapacitet, hvilket betyder, at det kan absorbere en masse varmeenergi, før dens temperatur stiger markant. Dette hjælper moderate temperaturændringer i organismer og miljøet.
5. Overflod:
* universelt opløsningsmiddel: Vand er det mest rigelige opløsningsmiddel på jorden, hvilket gør det let tilgængeligt til opløsning og transport af forskellige stoffer.
Sammenfattende skyldes vandets alsidighed som opløsningsmiddel dets polaritet, høje dielektriske konstant, sammenhængende og klæbende egenskaber, temperaturstabilitet og overflod. Disse faktorer gør vand essentielle for livet og spiller afgørende roller i biologiske, kemiske og geologiske processer.
 Varme artikler
Varme artikler
-
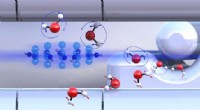 Sammenligning af vandisomerers kemiForsorterede ortho-vand- og para-vand-molekyler med forskelligt orienterede nukleare spins (blå eller røde pile) reagerer med diazenyliumioner (i midten til venstre) ved forskellige hastigheder. Kredi
Sammenligning af vandisomerers kemiForsorterede ortho-vand- og para-vand-molekyler med forskelligt orienterede nukleare spins (blå eller røde pile) reagerer med diazenyliumioner (i midten til venstre) ved forskellige hastigheder. Kredi -
 Magnesium tager FORMPNNLs Shear Assisted Processing and Extrusion™, eller FORM, teknologi. Kredit:Andrea Starr /Pacific Northwest National Laboratory To former for magnesiummateriale, der blev forarbejdet til rør ved
Magnesium tager FORMPNNLs Shear Assisted Processing and Extrusion™, eller FORM, teknologi. Kredit:Andrea Starr /Pacific Northwest National Laboratory To former for magnesiummateriale, der blev forarbejdet til rør ved -
 Ledige stillinger krystaldefekter nøglen til forbedret design af lette aluminiumslegeringerKredit:CC0 Public Domain Monash University-forskere i Australien har brugt en kombination af billeddannelse i atomskala og simuleringer til at forbedre forståelsen af theta-prime-forstærkningsfa
Ledige stillinger krystaldefekter nøglen til forbedret design af lette aluminiumslegeringerKredit:CC0 Public Domain Monash University-forskere i Australien har brugt en kombination af billeddannelse i atomskala og simuleringer til at forbedre forståelsen af theta-prime-forstærkningsfa -
 Forskere forbereder nyt lavtsmeltende, nitrogenholdigt, stannochlorophosphatglasSn-P-O-Cl-N glas fremstillet ved forskellige temperaturer. Kredit:SIOM Forskere fra Shanghai Institute of Optics and Fine Mechanics (SIOM) fra det kinesiske videnskabsakademi (CAS) har forberedt et
Forskere forbereder nyt lavtsmeltende, nitrogenholdigt, stannochlorophosphatglasSn-P-O-Cl-N glas fremstillet ved forskellige temperaturer. Kredit:SIOM Forskere fra Shanghai Institute of Optics and Fine Mechanics (SIOM) fra det kinesiske videnskabsakademi (CAS) har forberedt et
- Hvad får to DNA-strenge til at dele sig?
- Hvad er Saharas øje, også kendt som Richat-strukturen?
- Hvad er en samling af forskellige organismer, der bor i et økosystem?
- Hvorfor vokser planter med en bemærkelsesværdig hurtighed i ørkenen, når regn hælder ned?
- Hvilke kropsceller har normalt ikke en kerne?
- Hvad udgør en hydroxidion?


