Ville katalase virke på andre kemikalier end hydrogenperoxid?
Her er hvorfor:
* Aktiv stedspecificitet: Katalase har et meget specifikt aktivt sted, der er formet og ladet for perfekt at passe strukturen af hydrogenperoxid. Denne præcise pasning gør det muligt for enzymet at binde til underlaget og katalysere nedbrydningsreaktionen.
* reaktionsmekanisme: Katalase anvender en unik mekanisme, der involverer en jernholdig heme-gruppe til at nedbryde brintperoxid i vand og ilt. Denne mekanisme er optimeret til hydrogenperoxid og imødekommer ikke let andre molekyler.
Mens katalase undertiden kan udvise aktivitet over for andre molekyler, såsom alkylhydroperoxider , det er markant mindre effektivt sammenlignet med dens virkning på hydrogenperoxid. Dette betyder:
* Reaktionshastigheden er meget langsommere.
* Enzymets tilknytning til disse andre underlag er meget lavere.
Selvom katalase kan interagere med andre molekyler, er dens primære funktion at nedbryde brintperoxid. Det er et vigtigt enzym til at beskytte celler mod de skadelige virkninger af denne reaktive iltart.
Sidste artikelEn reaktion i levende ting, der forvandler sukker og ilt til kuldioxid?
Næste artikelNitrogenbasen, som guanine binder?
 Varme artikler
Varme artikler
-
 Effektiv fjernelse af radionuklider U(VI) ved hjælp af stavlignende metalorganiske strukturer (MOF-…Kredit:CC0 Public Domain Da radionuklidet 235U(VI) uundgåeligt frigives til det naturlige miljø, dets potentielle toksicitet og irreversibilitet har gjort det til et stort forureningsproblem i ato
Effektiv fjernelse af radionuklider U(VI) ved hjælp af stavlignende metalorganiske strukturer (MOF-…Kredit:CC0 Public Domain Da radionuklidet 235U(VI) uundgåeligt frigives til det naturlige miljø, dets potentielle toksicitet og irreversibilitet har gjort det til et stort forureningsproblem i ato -
 Forbedring af katalysatoren, der omdanner metan til syngasKredit:shutterstock Hokkaido University forskere har skabt en forbedret katalysator til omdannelse af metangas til syngas, en forløber for flydende brændstoffer og grundlæggende kemikalier. Synga
Forbedring af katalysatoren, der omdanner metan til syngasKredit:shutterstock Hokkaido University forskere har skabt en forbedret katalysator til omdannelse af metangas til syngas, en forløber for flydende brændstoffer og grundlæggende kemikalier. Synga -
 Neutroner undersøger iltgenererende enzym for en grønnere tilgang til rent vandKloritdismutase er et unikt oxygendannende enzym, der nedbryder chlorit, et industrielt forurenende stof, der findes globalt i grundvandet, drikkevand og jord. Forskning udført på ORNL bidrager til en
Neutroner undersøger iltgenererende enzym for en grønnere tilgang til rent vandKloritdismutase er et unikt oxygendannende enzym, der nedbryder chlorit, et industrielt forurenende stof, der findes globalt i grundvandet, drikkevand og jord. Forskning udført på ORNL bidrager til en -
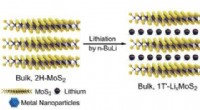 Brintproduktion i et begrænset rumFigur 1:Indkapslingen af ædelmetal nanopartikler i MoS2 ved en in-situ reduktion strategi. National University of Singapore kemikere har udviklet en metode til at begrænse ædelmetal -nanopartikl
Brintproduktion i et begrænset rumFigur 1:Indkapslingen af ædelmetal nanopartikler i MoS2 ved en in-situ reduktion strategi. National University of Singapore kemikere har udviklet en metode til at begrænse ædelmetal -nanopartikl
- Hvad er koncentrationsgradienter i mikrobiologi?
- En narhval boltrer sig med hvidhvalerne:Hvorfor interspecies adoptioner sker
- Hvornår er acceleration modsat bevægelsesretningen?
- Demonstrationen af ultrahurtig skift til en isolerende-lignende metastabil tilstand
- Hvad vil ikke udløse stjernedannelse?
- Opdagelse af signalprotein kan føre til lægemiddelbaserede terapier til behandling af hyperparathy…


