Hvad er forholdet mellem opløst koncentration og opløsningsmiddelkoncentration?
Her er en sammenbrud:
* opløst: Det stof, der opløses i et opløsningsmiddel.
* opløsningsmiddel: Det stof, der opløser opløsningen, skaber en løsning.
* Koncentration: Mængden af opløst stof opløst i en given mængde opløsningsmiddel.
Eksempel: Forestil dig et glas sukkervand.
* opløst: Sukker
* opløsningsmiddel: Vand
* Koncentration: Mængden af sukker opløst i vandet.
Hvis du tilsætter mere sukker (opløst) til vandet, øges koncentrationen af sukker i opløsningen. Imidlertid falder -koncentrationen af vand (opløsningsmiddel) proportionalt. Dette skyldes, at den samlede volumen af opløsningen forbliver den samme, men andelen af hver komponent ændres.
Nøglepunkter:
* Total koncentration: Summen af opløsningsmiddel- og opløsningsmiddelkoncentrationer forbliver altid konstant inden for en opløsning.
* koncentrationsenheder: Koncentration udtrykkes typisk som molaritet (mol/L), molalitet (mol/kg) eller procentdel (% ved masse eller volumen).
Kortfattet:
Forholdet mellem opløst stof og opløsningsmiddelkoncentrationer er en omvendt. Når den ene øges, falder den anden og opretholder en konstant total koncentration inden for opløsningen.
Sidste artikelHvilken organelle udfører fotosyntesen og producerer gas?
Næste artikelBakteriecellesure farvestoffer bærer hvilken ladning?
 Varme artikler
Varme artikler
-
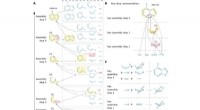 Samlingsteori kan betyde gode nyheder for lægemiddelopdagelseFig. 1. Repræsentationer af en samlingsvej, ved at tage adenin som eksempel. (A) En af adenins mange samlingsveje (det viser sig at være den korteste, ifølge vores MC-algoritme, forklaret senere). Sam
Samlingsteori kan betyde gode nyheder for lægemiddelopdagelseFig. 1. Repræsentationer af en samlingsvej, ved at tage adenin som eksempel. (A) En af adenins mange samlingsveje (det viser sig at være den korteste, ifølge vores MC-algoritme, forklaret senere). Sam -
 Proteinmodificeret fast elektrolyt-interfasedannelse og udvikling i Li-metalbatterierVed den forhøjede temperatur efter proteinholdig elektrolytfyldning danner proteinet en funktionel gruppe-rig SEI på Li-anode, der opbygger en jævn Li+ aflejring under cykling. Kredit:Journal of Energ
Proteinmodificeret fast elektrolyt-interfasedannelse og udvikling i Li-metalbatterierVed den forhøjede temperatur efter proteinholdig elektrolytfyldning danner proteinet en funktionel gruppe-rig SEI på Li-anode, der opbygger en jævn Li+ aflejring under cykling. Kredit:Journal of Energ -
 Guldbindingsdannelse spores i realtid ved hjælp af ny molekylær spektroskopi-teknikFigur 1:Et formskiftende molekyle snapper fra en bøjet (øverst til højre) til en lige struktur (nederst til højre), når det rammes af en ultraviolet laserimpuls (lilla krumspring øverst i midten). To
Guldbindingsdannelse spores i realtid ved hjælp af ny molekylær spektroskopi-teknikFigur 1:Et formskiftende molekyle snapper fra en bøjet (øverst til højre) til en lige struktur (nederst til højre), når det rammes af en ultraviolet laserimpuls (lilla krumspring øverst i midten). To -
 Makerspaces kunne muliggøre udbredt anvendelse af mikrofluidikMikrofluidiske enheder til at udføre forskellige assays blev skabt med værktøjerne i Lincoln Laboratorys Technology Office Innovation Laboratory. Kredit:Nicole Fandel I mere end et årti, videnskab
Makerspaces kunne muliggøre udbredt anvendelse af mikrofluidikMikrofluidiske enheder til at udføre forskellige assays blev skabt med værktøjerne i Lincoln Laboratorys Technology Office Innovation Laboratory. Kredit:Nicole Fandel I mere end et årti, videnskab
- Undersøgelse:Sorte amerikanere er mest interesserede i COVID-19-nyheder
- 9 ud af 10 LGBTQ+-elever siger, at de hører homofobisk sprog i skolen, og 1 ud af 3 hører det næs…
- Hvilke enheder bruges til at måle lydlyd og blødhed?
- Forskere opdager, hvordan dyr vokser deres spidse kropsdele
- Typer af Wolves
- Hvor gammel er Jorden i forhold til universets alder?


