Hvilken slags bindinger danner kulstof og nitrogen Hvorfor?
* Elektronegativitet: Både kulstof og nitrogen har relativt høje elektronegativitetsværdier. Dette betyder, at de begge har en stærk attraktion for elektroner. Mens nitrogen er lidt mere elektronegativ end kulstof, er forskellen ikke stor nok til at danne ioniske bindinger.
* Deling af elektroner: For at opnå en stabil elektronkonfiguration (som de ædle gasser) er både kulstof og nitrogen nødt til at dele elektroner med andre atomer. Denne deling af elektroner fører til dannelse af kovalente bindinger.
Typer af obligationer:
* enkelt obligationer: Den mest almindelige binding mellem kulstof og nitrogen er en enkelt binding, hvor de deler et par elektroner. Dette er repræsenteret af en enkelt linje i en strukturel formel (f.eks. C-N).
* dobbeltobligationer: Carbon og nitrogen kan også danne en dobbeltbinding, hvor de deler to par elektroner (f.eks. C =n).
* Triple Bonds: I nogle tilfælde er en tredobbelt obligation mulig, der involverer deling af tre par elektroner (f.eks. C≡N).
Betydning:
Kulstof- og nitrogens evne til at danne kovalente bindinger er vigtig i:
* Organisk kemi: De er grundlæggende byggesten af mange organiske molekyler, herunder aminosyrer (som udgør proteiner), nukleinsyrer (DNA og RNA) og mange andre biomolekyler.
* uorganisk kemi: Disse elementer danner vigtige forbindelser som ammoniak (NH₃), nitrogenoxider (NOX) og cyanider (CN⁻).
Kortfattet: Carbon og nitrogen danner kovalente bindinger, fordi de har lignende elektronegativiteter og har brug for at dele elektroner for at nå en stabil konfiguration. Denne bindingsdannende evne er afgørende for strukturen og funktionen af mange vigtige molekyler i både organisk og uorganisk kemi.
 Varme artikler
Varme artikler
-
 Team udvikler separator, der reducerer gasovergang til vandelektrolysatorSammenligning af porestørrelsesfordeling af separationsmembran:KIER separationsmembran (Z75 ~ Z85), Kommerciel membran (Zirfon). Kredit:Korea Institute of Energy Research (KIER) Dr. Won-chul Cho f
Team udvikler separator, der reducerer gasovergang til vandelektrolysatorSammenligning af porestørrelsesfordeling af separationsmembran:KIER separationsmembran (Z75 ~ Z85), Kommerciel membran (Zirfon). Kredit:Korea Institute of Energy Research (KIER) Dr. Won-chul Cho f -
 Placering af appelsinskalolie til nye, behagelige aromaforbindelserKredit:Pixabay/CC0 Public Domain Når appelsiner skrælles, sprøjter de en syrlig, citrusduftende olie ud i luften. Hovedforbindelsen i dufttågen er limonen, som kan opsamles fra kasserede skræller o
Placering af appelsinskalolie til nye, behagelige aromaforbindelserKredit:Pixabay/CC0 Public Domain Når appelsiner skrælles, sprøjter de en syrlig, citrusduftende olie ud i luften. Hovedforbindelsen i dufttågen er limonen, som kan opsamles fra kasserede skræller o -
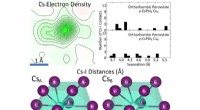 Kemikere løser oprindelsen til perovskit ustabilitet(Øverst til venstre) Rumtemperatur Cs elektrontæthed fra enkeltkrystal røntgendiffraktionsmålinger, der viser betydelig forlængelse, en underskrift af rasling. (Nederst) Cs-I-afstande for det dominere
Kemikere løser oprindelsen til perovskit ustabilitet(Øverst til venstre) Rumtemperatur Cs elektrontæthed fra enkeltkrystal røntgendiffraktionsmålinger, der viser betydelig forlængelse, en underskrift af rasling. (Nederst) Cs-I-afstande for det dominere -
 Innovationspionerer scorer verdens først for bæredygtigt byggeri med grafenbetonTeam fra University of Manchester og Nationwide Engineering om verdens første konstruerede grafenbeton i kommercielle omgivelser, kun et par kilometer øst for det gamle monument i Stonehenge, det nye
Innovationspionerer scorer verdens først for bæredygtigt byggeri med grafenbetonTeam fra University of Manchester og Nationwide Engineering om verdens første konstruerede grafenbeton i kommercielle omgivelser, kun et par kilometer øst for det gamle monument i Stonehenge, det nye
- Hvor mange valenselektroner skal aluminium miste være lykkelig?
- Sådan konverteres tæthed til kraft pr. Kubisk måler
- How many are there in our solar system and what they?
- Hvordan gærformationer startede
- Forskere kaster lys over sammensætningen af Jordens kerne
- Hvordan den afrikanske stribede mus fik sine striber


