Hvad kaldes processen, når vandmolekyler omgiver ioner under opløsning?
Her er hvorfor:
* vand er polært: Vandmolekyler har en lidt positiv ende (nær brintatomerne) og en lidt negativ ende (nær iltatomet). Dette gør dem tiltrukket af ioner.
* ioner opkræves: Når ioniske forbindelser opløses, adskiller de sig i positivt ladede kationer og negativt ladede anioner.
* attraktion og omgivelser: De positive ender af vandmolekyler omgiver anionerne, mens de negative ender af vandmolekyler omgiver kationerne. Denne attraktion hjælper med at overvinde kræfterne, der holder ionerne sammen i det faste, og giver dem mulighed for at sprede sig i vandet.
I det væsentlige danner vandmolekylerne en slags "hydratiseringsskal" omkring hver ion, hvilket svækker de ioniske bindinger og lader forbindelsen opløses.
Sidste artikelHvilke molekyler absorberer lys?
Næste artikelHvad er 4 elementer, der fremstiller organiske forbindelser?
 Varme artikler
Varme artikler
-
 Naturen er en nøgle til at afvise væskerBefugtende overflader med mikrosøjler (til venstre) mister deres omnifobicitet, når de beskadiges, mens mikroteksturer med dobbelt tilbagevendende hulrum (højre) udviser omnifobicitet trods lokalisere
Naturen er en nøgle til at afvise væskerBefugtende overflader med mikrosøjler (til venstre) mister deres omnifobicitet, når de beskadiges, mens mikroteksturer med dobbelt tilbagevendende hulrum (højre) udviser omnifobicitet trods lokalisere -
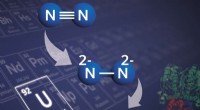 En uranbaseret forbindelse forbedrer fremstillingen af nitrogenprodukterEn illustration af, hvordan den uranbaserede forbindelse, der blev udviklet i denne undersøgelse, ville fungere. Kredit:Marinella Mazzanti/EPFL Kvælstof er rigeligt tilgængelig i naturen og danner
En uranbaseret forbindelse forbedrer fremstillingen af nitrogenprodukterEn illustration af, hvordan den uranbaserede forbindelse, der blev udviklet i denne undersøgelse, ville fungere. Kredit:Marinella Mazzanti/EPFL Kvælstof er rigeligt tilgængelig i naturen og danner -
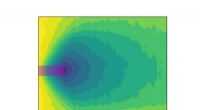 Nanocylindervibrationer hjælper med at kvantificere polymerhærdning til 3D-printFarvelagt plot af lys-assisteret hærdning af en polymer over fem sekunder, som målt med NISTs brugerdefinerede atomkraftmikroskop med en nanocylindersonde. Mørkere farver indikerer et højere niveau af
Nanocylindervibrationer hjælper med at kvantificere polymerhærdning til 3D-printFarvelagt plot af lys-assisteret hærdning af en polymer over fem sekunder, som målt med NISTs brugerdefinerede atomkraftmikroskop med en nanocylindersonde. Mørkere farver indikerer et højere niveau af -
 Selvhelbredende kompositter forlænger produktets levetidKredit:CompPair Næsten 20 millioner tons polymerkompositmaterialer produceres hvert år verden over, og markedet vokser med omkring 5% årligt. Det er ifølge JEC, en international sammensætningsindu
Selvhelbredende kompositter forlænger produktets levetidKredit:CompPair Næsten 20 millioner tons polymerkompositmaterialer produceres hvert år verden over, og markedet vokser med omkring 5% årligt. Det er ifølge JEC, en international sammensætningsindu
- Fysikere demonstrerer, hvordan lyd kan overføres gennem vakuum
- Forskere finder mulig årsag til kræftfremkaldende egenskaber ved silicastøv
- Du bruger sandsynligvis ikke Spotify rigtigt. Sådan får du mest muligt ud af din musik
- Hvordan ville tyngdekraften ændre sig, hvis begge masser blev fordoblet?
- Hvorfor er elektronerne i en binding mellem kulstof og ilt tættere på atom end atom?
- Amerikanske socialpolitikker hjalp med at forhindre børnefattigdom i at stige under den store reces…


