Hvad indikerer en pH?
Her er en sammenbrud:
* ph -skala: PH -skalaen varierer fra 0 til 14.
* Syre: Opløsninger med en pH mindre end 7 betragtes som sure. Jo lavere pH, jo stærkere syren.
* neutral: En pH på 7 er neutral. Rent vand har en pH på 7.
* alkalisk (eller grundlæggende): Løsninger med en pH -værdi på mere end 7 er alkaliske eller basale. Jo højere pH, jo stærkere er basen.
I det væsentlige måler pH koncentrationen af brintioner (H+) i en opløsning. En høj koncentration af H+ -ioner indikerer surhedsgrad, mens en lav koncentration indikerer alkalinitet.
Her er nogle virkelige eksempler på pH:
* mavesyre: Meget sur med en pH på omkring 2.
* citronsaft: Sur med en pH på ca. 2,4.
* kaffe: Lidt surt med en pH på ca. 5.
* rent vand: Neutral med en pH på 7.
* bagepulver løsning: Alkalisk med en pH på omkring 9.
* blegemiddel: Meget alkalisk med en pH på ca. 12,5.
Forståelse af PH er vigtig på mange felter, herunder:
* Kemi: Til analyse af kemiske reaktioner og stoffer af stoffer.
* biologi: Til undersøgelse af pH af celler og kropsvæsker.
* Landbrug: Til overvågning af jordsyre og justering af den for optimal plantevækst.
* miljøvidenskab: Til vurdering af vandkvalitet og forureningsniveauer.
* Fødevarevidenskab: Til kontrol af pH -værdien af fødevarer under forarbejdning og opbevaring.
 Varme artikler
Varme artikler
-
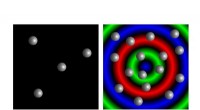 Ny forskning afslører potentiale for syntetiske materialesystemer, der kan tælle og fornemme deres…Modellerede mikrokapsler viser quorum sensing-adfærd. En lille samling mikrokapsler forbliver i dvale (til venstre), mens en stor, overfyldt befolkning udviser svingninger i kemisk aktivitet (til højr
Ny forskning afslører potentiale for syntetiske materialesystemer, der kan tælle og fornemme deres…Modellerede mikrokapsler viser quorum sensing-adfærd. En lille samling mikrokapsler forbliver i dvale (til venstre), mens en stor, overfyldt befolkning udviser svingninger i kemisk aktivitet (til højr -
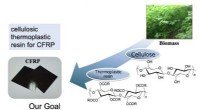 Elektronstråle styrker genanvendelig nanokompositFigur 1. Kulfiberforstærket plast med cellulosebaseret termoplast. Kredit:Kanazawa University Polymerer forstærket med kulfiber kombinerer styrke og lav vægt. De kan også prale af betydelige grønn
Elektronstråle styrker genanvendelig nanokompositFigur 1. Kulfiberforstærket plast med cellulosebaseret termoplast. Kredit:Kanazawa University Polymerer forstærket med kulfiber kombinerer styrke og lav vægt. De kan også prale af betydelige grønn -
 Polymer tvilling:Nyt implantat efterligner knoglestrukturImplantat, forberedt til kompressionstest. Kredit:Sergey Gnuskov/NUST MISIS Forskere fra National University of Science and Technology (MISIS) udviklede et unikt hybrid knogleimplantat, hvis kerne
Polymer tvilling:Nyt implantat efterligner knoglestrukturImplantat, forberedt til kompressionstest. Kredit:Sergey Gnuskov/NUST MISIS Forskere fra National University of Science and Technology (MISIS) udviklede et unikt hybrid knogleimplantat, hvis kerne -
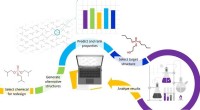 Sådan designes sikre og bæredygtige kemikalierMetode præsenteret af forskerne. Som et casestudie genererede de over seks millioner alternativer til en populær flammehæmmer og evaluerede deres egenskaber. Kredit:UvA/HIMS Med mange menneskeskabt
Sådan designes sikre og bæredygtige kemikalierMetode præsenteret af forskerne. Som et casestudie genererede de over seks millioner alternativer til en populær flammehæmmer og evaluerede deres egenskaber. Kredit:UvA/HIMS Med mange menneskeskabt
- Hvorfor prøver forskere at finde alternative energikilder nu?
- Når temperaturen reducerer hastigheden for en enzymkatalyseret reaktion også hvorfor?
- Hvordan sammenlignes bioforstørrelse med energipyramiden?
- To vikinge-slægtninge genforenet i Danmark efter 1. 000 år
- Hvad er elektronkonfiguration af B3?
- Hvordan fremstilles elektricitet i et kraftværk?


