Hvad er elektronkonfiguration af B3?
Her er hvorfor:
* Borons elektroniske konfiguration: Det neutrale boratom har den elektroniske konfiguration 1S² 2S²2P¹. Dette betyder, at det har 3 valenselektroner i sin yderste skal (2S²2P¹).
* B3+ iondannelse: For at danne B3+skulle bor skulle miste alle 3 af sine valenselektroner. Dette ville efterlade det med en tom ydre skal, hvilket resulterer i en meget ustabil kation med en +3 ladning.
Derfor findes en stabil elektronkonfiguration for B3+ ikke.
Det er vigtigt at bemærke, at B3+ kan observeres i ekstremt højenergimiljøer, men det ville ikke være en stabil eller almindelig art.
 Varme artikler
Varme artikler
-
 Skaber ringe i naturlig antibiotikasynteseTværfaglige undersøgelser afslører, hvordan naturen skaber et globalt brugt antibiotikum. Kredit:University of Bristol Forskere ved University of Bristol har afsløret hemmelighederne bag nøglering
Skaber ringe i naturlig antibiotikasynteseTværfaglige undersøgelser afslører, hvordan naturen skaber et globalt brugt antibiotikum. Kredit:University of Bristol Forskere ved University of Bristol har afsløret hemmelighederne bag nøglering -
 Russiske forskere udvikler et smart sorbent til vandrensningKredit:South Ural State University Forskere fra South Ural State University er engageret i oprettelsen af et multifunktionelt kulstofsorbent. Materialet vil være i stand til at optage både flere
Russiske forskere udvikler et smart sorbent til vandrensningKredit:South Ural State University Forskere fra South Ural State University er engageret i oprettelsen af et multifunktionelt kulstofsorbent. Materialet vil være i stand til at optage både flere -
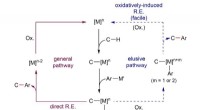 Forskere opnår arylering af CH-bindinger under milde forholdOxidation af metallet (M, iridium, blå vej) fører til et fald på 19 kcal/mol i reaktionens energibarriere, og tillader aryleringen at ske ved stuetemperatur. Kredit:Institut for Grundvidenskab Car
Forskere opnår arylering af CH-bindinger under milde forholdOxidation af metallet (M, iridium, blå vej) fører til et fald på 19 kcal/mol i reaktionens energibarriere, og tillader aryleringen at ske ved stuetemperatur. Kredit:Institut for Grundvidenskab Car -
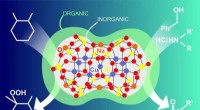 Kemikere syntetiserer en ny hybrid organisk-uorganisk katalysatorKredit:Natalia Deryugina RUDN -kemikere har syntetiseret metalkomplekser på basis af det organoelementale stof silsesquioxan, der består af en organisk og en uorganisk del. Sådanne hybridsystemer
Kemikere syntetiserer en ny hybrid organisk-uorganisk katalysatorKredit:Natalia Deryugina RUDN -kemikere har syntetiseret metalkomplekser på basis af det organoelementale stof silsesquioxan, der består af en organisk og en uorganisk del. Sådanne hybridsystemer


