Hvor mange gram CO2 produceres fra den brændende 1,0 mol amylalkohol?
1. Skriv den afbalancerede kemiske ligning:
Først skal vi kende den kemiske formel for amylalkohol (også kendt som pentanol) og produkterne fra dens forbrænding.
* Amylalkohol:C₅h₁₁oh
* Forbrændingsprodukter:CO₂ og H₂O
Den afbalancerede ligning er:
C₅H₁₁OH + 7O₂ → 5CO₂ + 6H₂O
2. Bestem molforholdet:
Den afbalancerede ligning fortæller os, at for hver 1 mol alkohol, der er brændt, produceres 5 mol co₂.
3. Beregn gram af co₂:
* molmasse af co₂: 12,01 g/mol (c) + 2 * 16,00 g/mol (O) =44,01 g/mol
* gram co₂ produceret: 1,0 mol amylalkohol * (5 mol co₂ / 1 mol amylalkohol) * (44,01 g co₂ / 1 mol co₂) = 220,05 g co₂
Derfor produceres 220,05 gram co₂ fra forbrænding af 1,0 mol amylalkohol.
 Varme artikler
Varme artikler
-
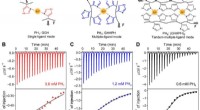 Molekylær konstruktion metalkoordinationsinteraktioner for stærke, hård, hurtigt genoprette hydro…Kooperativ ingeniørvirksomhed, bindingskonstanter, og molekylær mekanisme af metalion-koordinationsinteraktioner på molekylært niveau for belastningsbærende. (A) Metalionkoordinationskomplekserne dann
Molekylær konstruktion metalkoordinationsinteraktioner for stærke, hård, hurtigt genoprette hydro…Kooperativ ingeniørvirksomhed, bindingskonstanter, og molekylær mekanisme af metalion-koordinationsinteraktioner på molekylært niveau for belastningsbærende. (A) Metalionkoordinationskomplekserne dann -
 Analyse af fordele og ulemper ved to sammensatte fremstillingsmetoderKredit:Pixabay/CC0 Public Domain Flyvinger, vindmøllevinger, og andre store dele er typisk fremstillet ved hjælp af bulkpolymerisation i kompositproduktionsfaciliteter. De opvarmes og hærdes i eno
Analyse af fordele og ulemper ved to sammensatte fremstillingsmetoderKredit:Pixabay/CC0 Public Domain Flyvinger, vindmøllevinger, og andre store dele er typisk fremstillet ved hjælp af bulkpolymerisation i kompositproduktionsfaciliteter. De opvarmes og hærdes i eno -
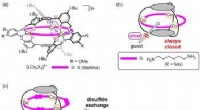 Et lukket burlignende molekyle, der kan åbnesFig.1 Oprindeligt lukket molekylærbur (til venstre). Disulfidbindinger kan brydes via reaktioner med thiolatanioner, resulterer i dannelse af åbninger (højre). Kredit:Kanazawa University Forskere
Et lukket burlignende molekyle, der kan åbnesFig.1 Oprindeligt lukket molekylærbur (til venstre). Disulfidbindinger kan brydes via reaktioner med thiolatanioner, resulterer i dannelse af åbninger (højre). Kredit:Kanazawa University Forskere -
 Justerbare omvendte fotokromer i fast tilstandKredit:ICN2 Fotokrome er farvestoffer, der ændrer deres farve afhængigt af det lys, de modtager. Når lyset er slukket, kan de enten forblive i deres fotoinducerede tilstand (P-type fotokromer) ell
Justerbare omvendte fotokromer i fast tilstandKredit:ICN2 Fotokrome er farvestoffer, der ændrer deres farve afhængigt af det lys, de modtager. Når lyset er slukket, kan de enten forblive i deres fotoinducerede tilstand (P-type fotokromer) ell
- Hvem kom med ideen om Lunar Orbit Rendezvous?
- Tøjvask er en topkilde til mikroplastikforurening - her er, hvordan du rengør dit tøj mere bæred…
- Er vindkraft en type solenergi?
- Tyfonen Shanshan klipper Japans kyst, skåne Tokyo
- Billede:Saturn-vendende halvkugle af Enceladus
- Forudsigelse af klimaanomalier:En reel udfordring


