Hvad er vandmoluekylernes evne til at danne hydrogenbindinger med andre kritiske?
1. Højt kogepunkt og smeltepunkt:
* Hydrogenbindinger kræver en betydelig mængde energi for at bryde. Dette betyder, at vand har et relativt højt kogepunkt (100 ° C) og smeltepunkt (0 ° C) sammenlignet med andre molekyler i lignende størrelse. Dette gør det muligt for vand at eksistere som en væske over en lang række temperaturer, der er vigtigt for livet på jorden.
2. Høj specifik varmekapacitet:
* Vand kan absorbere en masse varme, før dens temperatur øges markant. Dette skyldes den energi, der kræves for at bryde brintbindinger. Denne høje specifikke varmekapacitet hjælper med at regulere temperaturen, hvilket gør den ideel til biologiske systemer og klimaer.
3. Fremragende opløsningsmiddel:
* Vandets polaritet og evne til at danne brintbindinger gør det til et fremragende opløsningsmiddel for mange polære og ioniske stoffer. Dette muliggør transport af næringsstoffer og affald inden for organismer og i miljøet.
4. Samhørighed og vedhæftning:
* Hydrogenbindinger mellem vandmolekyler fører til stærke sammenhængende kræfter (tiltrækning mellem vandmolekyler) og klæbende kræfter (tiltrækning mellem vandmolekyler og andre overflader). Dette bidrager til overfladespænding, kapillær handling og vandets evne til at bevæge sig gennem planter og andre systemer.
5. Biologisk betydning:
* Vand er det primære opløsningsmiddel i levende organismer, der letter biokemiske reaktioner og transport af stoffer.
* Hydrogenbinding er afgørende for proteinstruktur og funktion, DNA -struktur og cellemembranstabilitet.
Kortfattet: Hydrogenbindingsevnen for vandmolekyler er grundlaget for mange af dets væsentlige egenskaber, hvilket gør det til en kritisk komponent for livet på jorden.
Sidste artikelHvad er konsekvenserne af opløsningsmiddelegenskaber vand?
Næste artikelHvad stabiliserer en aminosyre -helix?
 Varme artikler
Varme artikler
-
 Siger mod at forbedre fælles forbindelsesteknologier til letvægts- og højstyrkestrukturerTynd GFRP forstærkning. Kredit:Toyohashi University of Technology. Forskerholdet (ledet af professor Yukihiro Matsumoto) dannet af Institut for Arkitektur og Bygningsteknik ved Toyohashi University
Siger mod at forbedre fælles forbindelsesteknologier til letvægts- og højstyrkestrukturerTynd GFRP forstærkning. Kredit:Toyohashi University of Technology. Forskerholdet (ledet af professor Yukihiro Matsumoto) dannet af Institut for Arkitektur og Bygningsteknik ved Toyohashi University -
 DNA-skader forårsaget af migrerende lysenergiDNA udsættes for UV-stråling fra LEDer for at undersøge, hvor langt fotoenergien migrerer. Kredit:Arthur Kuhlmann, SÆT Ultraviolet lys bringer integriteten af menneskelig genetisk information i
DNA-skader forårsaget af migrerende lysenergiDNA udsættes for UV-stråling fra LEDer for at undersøge, hvor langt fotoenergien migrerer. Kredit:Arthur Kuhlmann, SÆT Ultraviolet lys bringer integriteten af menneskelig genetisk information i -
 C9h -peptid er begrænset til at fremkalde kræftcelle -apoptoseKredit:Asociación RUVID Forskere ved Valencias Universitat Politècnica (UPV), Valencia-CSIC Biomedicine Institute (IBV) og Bioengineering, Biomateriale og nanomedicin CIBER (CIBER BBN) har udvikle
C9h -peptid er begrænset til at fremkalde kræftcelle -apoptoseKredit:Asociación RUVID Forskere ved Valencias Universitat Politècnica (UPV), Valencia-CSIC Biomedicine Institute (IBV) og Bioengineering, Biomateriale og nanomedicin CIBER (CIBER BBN) har udvikle -
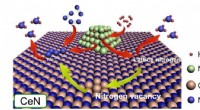 Fyldning af hulrummet i ammoniaksyntese:Nitrogenniveauernes rolle i katalysatorerNikkelpartikler dissocierer H2 for at tilvejebringe H -atomer til enten N -atomer fra selve CeN -krystalgitteret eller fremspringende N -atomer fra N2 -molekyler, der udfylder et nitrogenrum. I dette
Fyldning af hulrummet i ammoniaksyntese:Nitrogenniveauernes rolle i katalysatorerNikkelpartikler dissocierer H2 for at tilvejebringe H -atomer til enten N -atomer fra selve CeN -krystalgitteret eller fremspringende N -atomer fra N2 -molekyler, der udfylder et nitrogenrum. I dette
- Hvad er forskellen mellem potentiel og kinetisk energi i et vendiagram?
- Nyt sensorsystem sikrer brændstofkvaliteten på brinttankstationer
- Hvilke 5 syrer bruger vi i vores daglige liv?
- Terraced grafen til ultrafølsom magnetfeltsensor
- Russias Mayak-satellit:mængdefinansieret kosmisk skadedyr eller velkommen natlig besøgende?
- Kilde til farlige højenergipartikler placeret i Solen


