Hvad er det stof, der kan optage eller frigive brintioner i opløsning som koncentration af ændringer?
syrer er stoffer, der donerer brintioner (H+) til en opløsning. Når en syre opløses i vand, frigiver den H+ -ioner, hvilket øger koncentrationen af H+ i opløsningen. Dette gør løsningen mere sur .
baser er stoffer, der accepterer brintioner (H+) fra en opløsning. Når en base opløses i vand, fjerner den H+ -ioner fra opløsningen og reducerer koncentrationen af H+ i opløsningen. Dette gør opløsningen mindre sur (mere grundlæggende eller alkalisk) .
Her er nogle eksempler:
* syrer: Hydrochlorsyre (HCI), svovlsyre (H2SO4), eddikesyre (CH3COOH)
* baser: Natriumhydroxid (NaOH), kaliumhydroxid (KOH), ammoniak (NH3)
ph -skala bruges til at måle surhedsgraden eller alkaliniteten af en opløsning. En pH -værdi på 7 er neutral, under 7 er sur, og over 7 er grundlæggende (alkalisk).
Syrens og basernes evne til at donere eller acceptere hydrogenioner er grundlaget for mange kemiske reaktioner og processer, herunder:
* neutraliseringsreaktioner: Når en syre og en base reagerer, neutraliserer de hinanden og danner vand (H2O) og et salt.
* Buffer -systemer: Biologiske systemer bruger buffere til at opretholde en stabil pH. Buffere er opløsninger, der modstår ændringer i pH, når små mængder syre eller base tilsættes.
* syre-base titrering: En metode anvendt til at bestemme koncentrationen af en ukendt syre eller base.
Sammenfattende syrer og baser er stoffer, der kan ændre koncentrationen af brintioner i en opløsning, hvilket gør den mere sur eller grundlæggende. Disse ændringer i pH har betydelige konsekvenser i forskellige kemiske reaktioner og biologiske processer.
Sidste artikelHvad er rolle i organiske molekyler?
Næste artikelHvad er kravene til lysreaktion?
 Varme artikler
Varme artikler
-
 Beskadigede planter og falske parfumer kan identificeres hurtigt og pålideligt i realtidHarpiksen, der udskilles af et beskadiget nåletræ for at beskytte skadestedet, har sin egen karakteristiske chirale signatur inden for anlæggets samlede emissioner. Kredit:Lykourgos Bougas Den chir
Beskadigede planter og falske parfumer kan identificeres hurtigt og pålideligt i realtidHarpiksen, der udskilles af et beskadiget nåletræ for at beskytte skadestedet, har sin egen karakteristiske chirale signatur inden for anlæggets samlede emissioner. Kredit:Lykourgos Bougas Den chir -
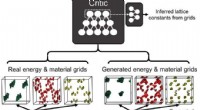 Omvendt design af porøse materialer ved hjælp af kunstige neurale netværkOverordnede skemaer af ZeoGAN. Energi (grøn) refererer i dette tilfælde til potentiel metanenergi, og materialegitter angiver silicium (rød) og oxygen (gule) atomer. Kredit:Science Advances, doi:10.11
Omvendt design af porøse materialer ved hjælp af kunstige neurale netværkOverordnede skemaer af ZeoGAN. Energi (grøn) refererer i dette tilfælde til potentiel metanenergi, og materialegitter angiver silicium (rød) og oxygen (gule) atomer. Kredit:Science Advances, doi:10.11 -
 Forskere bruger kunstige neurale netværk til at strømline materialetestningNikhil Gupta, lektor i maskin- og rumfartsteknik og ph.d. studerende Xianbo Xu. Kredit:NYU Tandon School of Engineering Optimering af avancerede kompositter til specifikke slutanvendelser kan være
Forskere bruger kunstige neurale netværk til at strømline materialetestningNikhil Gupta, lektor i maskin- og rumfartsteknik og ph.d. studerende Xianbo Xu. Kredit:NYU Tandon School of Engineering Optimering af avancerede kompositter til specifikke slutanvendelser kan være -
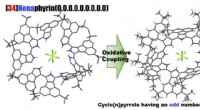 Syntese af en nær-infrarød lysabsorberende makrocyklisk aromatisk forbindelseSelektiv syntese af Cyclo [9] pyrroler Baseret på en oxidativ kobling. Kredit:Tetsuo Okujima, Ehime Universitet Profs. Okujima og Uno ved Ehime University, i samarbejde med prof. Kobayashi ved Shi
Syntese af en nær-infrarød lysabsorberende makrocyklisk aromatisk forbindelseSelektiv syntese af Cyclo [9] pyrroler Baseret på en oxidativ kobling. Kredit:Tetsuo Okujima, Ehime Universitet Profs. Okujima og Uno ved Ehime University, i samarbejde med prof. Kobayashi ved Shi


