Faster højere temperatur op en kemisk reaktion?
* Øget kinetisk energi: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Ved højere temperaturer bevæger molekyler sig hurtigere og kolliderer oftere.
* mere effektive kollisioner: Disse hurtigere kollisioner er mere tilbøjelige til at have nok energi til at bryde bindinger og danne nye, de væsentlige trin i en kemisk reaktion.
* Aktiveringsenergi: Hver reaktion kræver en bestemt minimumsenergi, kaldet aktiveringsenergi, for at reaktionen kan forekomme. Forøget temperatur giver flere molekyler nok energi til at overvinde denne aktiveringsbarriere.
Undtagelser:
Mens højere temperaturer generelt fremskynder reaktioner, er der undtagelser:
* ligevægtsreaktioner: Nogle reaktioner er reversible og når en ligevægt, hvor hastighederne for de fremadgående og omvendte reaktioner er ens. I disse tilfælde kan stigende temperatur favorisere den ene retning i forhold til den anden, men den vil ikke nødvendigvis øge den samlede reaktionshastighed.
* Nedbrydningsreaktioner: Nogle reaktioner, som nedbrydningen af visse forbindelser, kan bremse ved højere temperaturer.
* enzymer: Biologiske reaktioner, der er katalyseret af enzymer, har optimale temperaturområder. Over dette interval kan enzymet blive denatureret og miste sin aktivitet.
Kortfattet: Højere temperaturer øger generelt hastigheden for kemiske reaktioner ved at tilvejebringe mere energi til molekyler til at kollidere effektivt og overvinde aktiveringsenergibarrierer. Der er dog undtagelser fra denne generelle regel, og den specifikke virkning af temperatur på en reaktion afhænger af arten af selve reaktionen.
 Varme artikler
Varme artikler
-
 Forskere klokke DNAs restitutionstid efter kemoterapiDNA, som har en dobbelt helix struktur, kan have mange genetiske mutationer og variationer. Kredit:NIH I den tid det tager for en Amazon Prime-levering at ankomme, celler beskadiget af kemoterapi
Forskere klokke DNAs restitutionstid efter kemoterapiDNA, som har en dobbelt helix struktur, kan have mange genetiske mutationer og variationer. Kredit:NIH I den tid det tager for en Amazon Prime-levering at ankomme, celler beskadiget af kemoterapi -
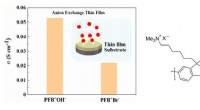 Den første hydroxidledningsevne i anionledende polymer tynde filmFigur 1:Den første måling af hydroxidledningsevne og sammenligning i anionledende polymer tynde film. (X =OH og Br). Kredit:Japan Advanced Institute of Science and Technology Efterhånden som dekar
Den første hydroxidledningsevne i anionledende polymer tynde filmFigur 1:Den første måling af hydroxidledningsevne og sammenligning i anionledende polymer tynde film. (X =OH og Br). Kredit:Japan Advanced Institute of Science and Technology Efterhånden som dekar -
 Forskere hjælper med at udvikle bæredygtige polymererUndersøgelsen af Rufina Alamo og den tidligere doktorand Xiaoshi Zhang blev vist på forsiden af Macromolecules. Alamo og Zhang designede illustrationen, og Zhang tegnede det. Kredit:Xiaoshi Zhang
Forskere hjælper med at udvikle bæredygtige polymererUndersøgelsen af Rufina Alamo og den tidligere doktorand Xiaoshi Zhang blev vist på forsiden af Macromolecules. Alamo og Zhang designede illustrationen, og Zhang tegnede det. Kredit:Xiaoshi Zhang -
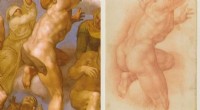 Ny hydrogel udviklet til at fjerne tape fra århundreder gammel tegning(Venstre) Detalje fra Ascesa dei Beati (Michelangelo Buonarroti) fra Det Sixtinske Kapel; (Til højre) tegning fra 1500-tallet, der gengiver den samme detalje. En indskrift di mano di Michelangelo (fra
Ny hydrogel udviklet til at fjerne tape fra århundreder gammel tegning(Venstre) Detalje fra Ascesa dei Beati (Michelangelo Buonarroti) fra Det Sixtinske Kapel; (Til højre) tegning fra 1500-tallet, der gengiver den samme detalje. En indskrift di mano di Michelangelo (fra
- Når metalatom mister elektronenergi er?
- Undersøgelse finder racemæssig forskel mellem, hvad sorte og hvide låntagere betaler for boliglå…
- Hvad er dine velkendte begreber om balance -naturen?
- Kan en kovalent binde fra når elektroner overføres mellem 2 atomer?
- Hvad indeholder surt regn det meste af?
- Iqaluit kan begynde at løbe tør for ferskvand i 2024


