Kan et ikke -ionisk stof aldrig opløses i vand?
* opløselighed er kompleks: Opløselighed afhænger af flere faktorer, herunder:
* Intermolekylære kræfter: Vand er polært (har positive og negative ender) og danner stærke brintbindinger. Ikke -ioniske stoffer kan stadig opløses, hvis de har intermolekylære kræfter, der kan interagere positivt med vandmolekyler.
* Polaritet: Mens ikke -ioniske stoffer generelt har mindre polaritet end ioniske forbindelser, kan nogle stadig have tilstrækkelig polaritet til at opløses i vand.
* Temperatur: Opløselighed øges generelt med temperaturen.
* tryk: For gasser øges opløseligheden med tryk.
* Eksempler på ikke -ioniske stoffer, der opløses i vand:
* sukker (saccharose): Sukker er et ikke -ionisk, polært molekyle, der let opløses i vand.
* ethanol: Ethanol er et ikke -ionisk, polært molekyle, der er blandbart med vand (hvilket betyder, at det opløses i alle proportioner).
* Mange organiske molekyler: Selv nogle ikke -polære organiske molekyler kan opløses i lille grad i vand på grund af svage interaktioner.
Kortfattet: Et stofs evne til at opløses i vand afhænger af det specifikke samspil mellem faktorer, og mens ioniske forbindelser generelt opløses bedre, kan ikke -ioniske stoffer også opløses under visse betingelser.
 Varme artikler
Varme artikler
-
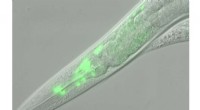 Hvad rundorme kan lære os om menneskelig vækstNår deres gen for det thyrotropin-frigivende hormon (TRH) deaktiveres, rundorme forbliver mindre end deres sunde modparter. Orme med ekstra TRH, derimod er større. Kredit:KU Leuven Mennesker og ru
Hvad rundorme kan lære os om menneskelig vækstNår deres gen for det thyrotropin-frigivende hormon (TRH) deaktiveres, rundorme forbliver mindre end deres sunde modparter. Orme med ekstra TRH, derimod er større. Kredit:KU Leuven Mennesker og ru -
 Accelererende udvikling af STT-MRAMKredit:Tohoku University Forskere ved Center for Innovative Integrated Electronic Systems (CIES) ved Tohoku University har med succes observeret mikroskopiske kemiske bindingstilstande i ultratynd
Accelererende udvikling af STT-MRAMKredit:Tohoku University Forskere ved Center for Innovative Integrated Electronic Systems (CIES) ved Tohoku University har med succes observeret mikroskopiske kemiske bindingstilstande i ultratynd -
 Forskere opdager forbindelser, der kunne have været med til at starte liv på JordenFosforatomer i gult, iltatomer indblandet. Kredit:Britvin et al / Geology, 2020 Fosfor er et element, der er afgørende for livet. Det er grundlæggende for alle levende organismer, og er en nøgleko
Forskere opdager forbindelser, der kunne have været med til at starte liv på JordenFosforatomer i gult, iltatomer indblandet. Kredit:Britvin et al / Geology, 2020 Fosfor er et element, der er afgørende for livet. Det er grundlæggende for alle levende organismer, og er en nøgleko -
 Ny influenza test let som vejrtrækning, med hurtigere resultaterDen nye teknik er i stand til at opdage influenzainfektion, efter at patienten kun ånder i få minutter i beholderen, siger Laila Ladhani, Ph.d. -studerende i mikro- og nanosystemer på KTH. Kredit:KTH
Ny influenza test let som vejrtrækning, med hurtigere resultaterDen nye teknik er i stand til at opdage influenzainfektion, efter at patienten kun ånder i få minutter i beholderen, siger Laila Ladhani, Ph.d. -studerende i mikro- og nanosystemer på KTH. Kredit:KTH


