Sådan Find Mole Ratio
Når du sammenligner mængder kemikalier, da de vedrører hinanden, har du brug for molforholdet. En mol er 6,022 x 10 ^ 23, eller Avogadros nummer, molekyler eller atomer af ethvert stof. Molforholdet sammenligner antallet af mol af et stof i en kemisk ligning med et andet stof, normalt på den modsatte side af ligningen. Stoichiometri er et område inden for kemi, der beskæftiger sig med mængder kemikalier i reaktioner og bruger derfor molforholdet meget.
Bestem hvilke elementer eller forbindelser der er i din reaktion og skriv skelettens ligning. Ligningen i dette eksempel er brændingen af propan for at få kuldioxid og vand.
C3H8 + O2 ---> CO2 + H2O
Bestem de nødvendige koefficienter for at afbalancere antallet af atomer på hver side af ligningen. I dette eksempel har du tre carbonatomer på venstre side og et carbonatom til højre, så giv CO2-termen en koefficient på 3. Gør den samme beregning for hydrogenatomerne. Vand får så en koefficient på 4.
C3H8 +? O2 ---> 3 CO2 + 4 H2O
Bemærk at alle vilkårene på højre side nu har koefficienter. Brug dem til at beregne antallet af O2 molekyler, der kræves på venstre side.
C3H8 + 5 O2 ---> 3 CO2 + 4 H2O
Beregn molforholdet. Start med de mængder, der er givet til dig i problemet. Et typisk spørgsmål kan være, "Hvor meget propan skal brændes for at få en gallon vand?" Vand i dette problem er den kendte mængde, så vandtemperaturens koefficient i ligningen går ind i nævneren (bunden) af forholdet. Koefficienten for den ukendte mængde - propan i dette eksempel - går ind i tælleren. For hver mol propan brændt i dette eksempel får du 4 mol vand.
Moleforhold = 1/4
Sidste artikelSådan bruges laddermetoden med metriske konverteringer
Næste artikelSådan finder du et område med en trekant fra dets hjørner
 Varme artikler
Varme artikler
-
 Sådan konverteres mikroner til måling af tykkelseUanset om du køber skraldespand til garagen, tinfolie til køkkenet eller metalpladen til din virksomhed, er det vigtigt at købe produktet med de rigtige egenskaber for at få arbejdet færdigt. Egenskab
Sådan konverteres mikroner til måling af tykkelseUanset om du køber skraldespand til garagen, tinfolie til køkkenet eller metalpladen til din virksomhed, er det vigtigt at købe produktet med de rigtige egenskaber for at få arbejdet færdigt. Egenskab -
 Børnehaveaktiviteter for volumenUndervisning af matematiske begreber som volumen til børnehavebørn er bedst opnået ved hjælp af ægte objekter, også kaldet manipulativer. Børn i denne alder har en naturlig nysgerrighed og bruger dere
Børnehaveaktiviteter for volumenUndervisning af matematiske begreber som volumen til børnehavebørn er bedst opnået ved hjælp af ægte objekter, også kaldet manipulativer. Børn i denne alder har en naturlig nysgerrighed og bruger dere -
 Simple Sudoku Instruktioner for BørnSudoku er et japansk nummer puslespil, at børn i mange aldre er i stand til succesfuldt at fuldføre og nyde. Ifølge Math and Reading Help i Sudoku: et logisk baseret pædagogisk puslespil til børn, hjæ
Simple Sudoku Instruktioner for BørnSudoku er et japansk nummer puslespil, at børn i mange aldre er i stand til succesfuldt at fuldføre og nyde. Ifølge Math and Reading Help i Sudoku: et logisk baseret pædagogisk puslespil til børn, hjæ -
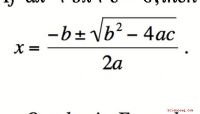 Hvordan er faktoren af polynomier brugt i hverdagen?Factoring af et polynom refererer til at finde polynomier af lavere orden (højeste eksponent er lavere), der multipliceres sammen, producerer polynomet, der faktureres. For eksempel kan x ^ 2 - 1 indr
Hvordan er faktoren af polynomier brugt i hverdagen?Factoring af et polynom refererer til at finde polynomier af lavere orden (højeste eksponent er lavere), der multipliceres sammen, producerer polynomet, der faktureres. For eksempel kan x ^ 2 - 1 indr


