Hvorfor findes halogengruppen fri i naturen?
* Høj elektronegativitet: Halogener har en høj elektronegativitet, hvilket betyder, at de har en stærk tendens til at vinde elektroner og danne negative ioner (ANION).
* stærke oxidationsmidler: Deres høje elektronegativitet gør dem til stærke oxidationsmidler og reagerer let med andre elementer for at danne forbindelser.
* reaktiv med metaller: Halogener reagerer let med metaller for at danne salte. For eksempel reagerer klor med natrium til dannelse af natriumchlorid (bordsalt).
Undtagelser:
* fluor: Fluor er den mest reaktive halogen og findes i mineralfluorit (CAF2).
* klor: Små mængder klor findes opløst i havvand og i nogle vulkanske gasser.
* brom: Bromer findes i små mængder som bromidioner (Br-) i havvand.
* jod: Jod er til stede i spormængder i havvand og i nogle mineraler.
Sammendrag:
Halogener er meget reaktive på grund af deres høje elektronegativitet og findes sjældent fri i naturen. De findes typisk som forbindelser med andre elementer, ofte som salte eller i opløste former.
 Varme artikler
Varme artikler
-
 Et nyopdaget rev tilbyder vigtige lektioner i modstandsdygtighedPenn State koralrevbiologer studerer Varadero rev, ud for Colombias kyst, at lære, hvorfor det trives under usædvanlige forhold. På billedet ses den tidligere postdoktor Joe Pollock. Kredit:Joseph Pol
Et nyopdaget rev tilbyder vigtige lektioner i modstandsdygtighedPenn State koralrevbiologer studerer Varadero rev, ud for Colombias kyst, at lære, hvorfor det trives under usædvanlige forhold. På billedet ses den tidligere postdoktor Joe Pollock. Kredit:Joseph Pol -
 Fosforforurening når farlige niveauer på verdensplan, ny undersøgelse finderAlgeblomster kan give problemer for økosystemer og det menneskelige samfund. En ny undersøgelse tyder på, at ferskvandsforekomster i områder med høje vandforureningsniveauer sandsynligvis vil lide af
Fosforforurening når farlige niveauer på verdensplan, ny undersøgelse finderAlgeblomster kan give problemer for økosystemer og det menneskelige samfund. En ny undersøgelse tyder på, at ferskvandsforekomster i områder med høje vandforureningsniveauer sandsynligvis vil lide af -
 Sydafrika erklærer tørke som en national katastrofeSydafrika erklærede en national katastrofe på grund af en tørke, der har hærget dele af landet og truet med at forlade byen Cape Town uden brugsvand fra postevand Sydafrika erklærede tirsdag en na
Sydafrika erklærer tørke som en national katastrofeSydafrika erklærede en national katastrofe på grund af en tørke, der har hærget dele af landet og truet med at forlade byen Cape Town uden brugsvand fra postevand Sydafrika erklærede tirsdag en na -
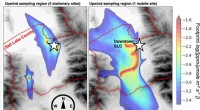 At tage drivhusgasanalyser med på vejen, øh, skinnerDet atmosfæriske område mod vinden, der er samplet af fire aktuelle stationære luftkvalitetsmonitorer (venstre) sammenlignet med området, der er samplet af en togbaseret mobil sensor. Kredit:Universit
At tage drivhusgasanalyser med på vejen, øh, skinnerDet atmosfæriske område mod vinden, der er samplet af fire aktuelle stationære luftkvalitetsmonitorer (venstre) sammenlignet med området, der er samplet af en togbaseret mobil sensor. Kredit:Universit
- Astronomer opdager en tæt, varm Jupiter-exoplanet, der kredser om en sollignende stjerne
- Ujævne havniveaustigninger bundet til klimaændringer
- Bakterier som pacemaker til tarmen
- Udenlandske skraldespand som skatte i Indonesias plastby
- Hvorfor beryllium danner amfoterisk oxid?
- Bemærkelsesværdig fossil hule viser, hvordan gamle pungdyr voksede


