NIST -teamet går fremad i oversættelse af sprog i nanoporer
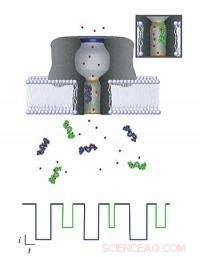
Hvert molekyle, der passerer gennem nanoporen, kan identificeres ved at overvåge den ændring, det forårsager i en ionisk strøm, der flyder hen over membranen. Når forskellige molekyler (lilla og grønne genstande) kommer ind i poren (grønt vist med indsats), hver reducerer strømmen med en bestemt mængde og tidsperiode (vist ved tilsvarende farveskema i det aktuelle diagram herunder), afhængigt af både dens størrelse og evne til at tiltrække nærliggende ioner (røde prikker). NIST -modellen kan bruges til at udtrække disse oplysninger, som kan bruges til at identificere og karakterisere biomarkører til medicinske anvendelser. Kredit:NIST
National Institute of Standards and Technology forskere er gået et skridt tættere på at udvikle midlerne til en hurtig diagnostisk blodprøve, der kan scanne for tusinder af sygdomsmarkører og andre kemiske sundhedsindikatorer. Teamet rapporterer, at det har lært at afkode de elektriske signaler, der genereres af en nanopore - en "port", der er mindre end 2 nanometer bred i en kunstig cellemembran.
Nanoporer er ikke selv nye; i mere end et årti, forskere har søgt at bruge en nanopore-baseret elektrisk detektor til at karakterisere enkeltstrenget DNA til genetiske sekventeringsapplikationer. For nylig, NIST -forskere vendte deres opmærksomhed mod at bruge nanoporer til at identificere, kvantificere og karakterisere hver af de mere end 20, 000 proteiner kroppen producerer - en kapacitet, der ville give et øjebliksbillede af en patients generelle helbred på et givet tidspunkt. Men mens nanoporer tillader molekyler at komme ind i dem en ad gangen, Det har ikke været let at bestemme, hvilket specifikt individuelt molekyle der lige er gået igennem.
For at løse dette problem, medlemmer af NIST -teamet, der tidligere har udviklet en metode til at skelne både størrelsen og koncentrationen af hver type molekyle, nanoporen indrømmer, har nu besvaret spørgsmålet om, hvordan disse enkelte molekyler interagerer med nanoporen. Deres nye teoretiske model beskriver fysik og kemi for, hvordan nanoporen, træde i kræft, analyserer et molekyle, en forståelse, der vil fremme brugen af nanoporer på det medicinske område.
"Dette arbejde bringer os et skridt tættere på at realisere disse nanoporer som et kraftfuldt diagnostisk værktøj til medicinsk videnskab, "siger Joseph Reiner, der udførte arbejdet med Joseph Robertson, og John Kasianowicz, alle NIST's Semiconductor Electronics Division. "Det føjer til 'Rosetta Stone', der giver os mulighed for at læse, hvilke molekyler der lige er passeret gennem en nanopore."
Ved hjælp af deres nye metoder, teamet var i stand til at modellere interaktionen mellem en bestemt type stort molekyle gennem en nanopores åbning med stor nøjagtighed. Molekylerne var polyethylenglycol (PEG), en velkendt polymer, der danner kæder af varierende længde.
"PEG -kæder kan være meget lange, men hvert link er meget lille, "Kasianowicz siger." Det var en god test, fordi vi ville se, om nanoporen kunne skelne mellem to næsten identiske store molekyler, der kun adskiller sig i længde med få atomer. "
Holdets enhed kunne let skelne mellem forskellige PEG-kæder i forskellige størrelser, og den model, de har udviklet til at beskrive PEG-nanopore-interaktionerne, opmuntrer dem til at tro, at med yderligere indsats de små sensorer kan tilpasses til hurtigt at måle mange forskellige molekyler. "Vi kunne tænkes at bygge en række af mange nanoporer, hver enkelt skabt til at måle et bestemt stof, "Siger Kasianowicz." Fordi hver nanopore er så lille, en matrix med et for hvert protein i kroppen ville stadig være lille. "
 Varme artikler
Varme artikler
-
 Samler lys med kunstige møløjneDette billede viser, hvordan «moløjet solcelle» fungerer:ved hjælp af sollys opdeles vandmolekyler til ilt og brint. Kredit:Empa Overalt i verden undersøger forskere solceller, der efterligner pla
Samler lys med kunstige møløjneDette billede viser, hvordan «moløjet solcelle» fungerer:ved hjælp af sollys opdeles vandmolekyler til ilt og brint. Kredit:Empa Overalt i verden undersøger forskere solceller, der efterligner pla -
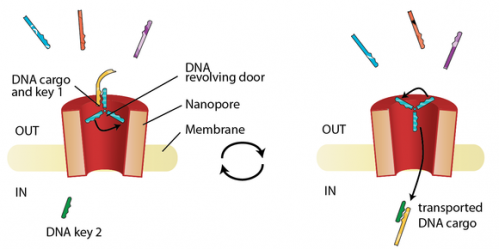 Nanopore åbner ny cellulær døråbning til medicintransportTil venstre:Hybridiseringen af et specifikt DNA-molekyle (nøgle 1) til DNA-svingdøren fremmer transporten af DNAet over nanoporen. Til højre:En specifik DNA-nøgle inde i cellerummet fremmer frigiv
Nanopore åbner ny cellulær døråbning til medicintransportTil venstre:Hybridiseringen af et specifikt DNA-molekyle (nøgle 1) til DNA-svingdøren fremmer transporten af DNAet over nanoporen. Til højre:En specifik DNA-nøgle inde i cellerummet fremmer frigiv -
 DNA-motor programmeret til at navigere i et netværk af sporEn afbildning af en DNA-origami-flise med et indbygget netværk af spor. DNA-motoren eller motoren, i rødt, kan programmeres til at navigere i en række vejkryds for at nå et af fire ønskede slutpunkter
DNA-motor programmeret til at navigere i et netværk af sporEn afbildning af en DNA-origami-flise med et indbygget netværk af spor. DNA-motoren eller motoren, i rødt, kan programmeres til at navigere i en række vejkryds for at nå et af fire ønskede slutpunkter -
 En matryoshka -dukke i bronze:Metallet i metallet i metalletLigesom i det russiske trælegetøj, et skrog med 12 kobberatomer omslutter et enkelt tinatom. Dette skrog er, på tur, omsluttet af 20 yderligere tinatomer. Med deres store overflader kan disse struktur
En matryoshka -dukke i bronze:Metallet i metallet i metalletLigesom i det russiske trælegetøj, et skrog med 12 kobberatomer omslutter et enkelt tinatom. Dette skrog er, på tur, omsluttet af 20 yderligere tinatomer. Med deres store overflader kan disse struktur
- Gruppen blaser vejen til effektiv, miljøvenlig dyb-ultraviolet LED
- Samarbejde skaber et gennembrud for bæredygtig elektronikproduktion
- Aktive skydeøvelser i skoler kan gøre mere skade end gavn
- Ny lavpristeknik konverterer bulklegeringer til oxidnanotråde
- Hvad er betydningen af termisk behandling?
- Hvorfor er optiske brydningsindekser så små?


