Korrigering af et trick af lyset bringer molekyler til syne
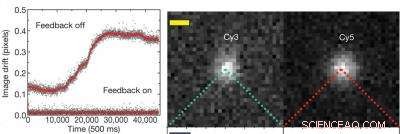
Grafen til venstre viser, at med det aktive feedback-system slukket er der en opløsningsdrift på omkring 0,3 pixels eller 19 nanometer, men med feedback -systemet vedligeholdes opløsningen på bedre end 0,01 pixels, eller omkring 0,64 nanometer. Billedet til højre viser individuelle cyanin (Cy) fluorescerende farvestofmolekyler - Cy3 og Cy5 - brugt til at mærke 20 basepar dobbeltstrenget DNA. Kredit:Udlånt af Steven Chu forskningsgruppe
Konventionel visdom hævder, at optisk mikroskopi ikke kan bruges til at "se" noget så lille som et individuelt molekyle. Men som det plejer, klog videnskab har igen væltet konventionel visdom. energiminister, Nobelpristager og tidligere direktør for Lawrence Berkeley National Laboratory (Berkeley Lab) Steven Chu ledede udviklingen af en teknik, der gør det muligt at bruge optisk mikroskopi til at afbilde objekter eller afstanden mellem dem med opløsninger så små som 0,5 nanometer - halvdelen af en milliardedel af en meter, eller en størrelsesorden mindre end den tidligere bedste.
"Evnen til at få sub-nanometer opløsning i biologisk relevante vandige miljøer har potentialet til at revolutionere biologien, især strukturel biologi, " siger sekretær Chu. "En af motivationerne for dette arbejde, for eksempel, skulle måle afstande mellem proteiner, der danner multi-domæne, meget komplekse strukturer, såsom proteinsamlingen, der danner det humane RNA-polymerase II-system, som starter DNA-transkription."
Sekretær Chu er medforfatter til et papir, der nu vises i tidsskriftet Natur der beskriver denne forskning. Artiklen har titlen "Subnanometer enkelt-molekyle lokalisering, registrering og afstandsmålinger." De andre forfattere er Alexandros Pertsinidis, en post-doc forsker og medlem af Chus forskningsgruppe ved University of California (UC) Berkeley, som nu er adjunkt ved Sloan-Kettering Institute, og Yunxiang Zhang, medlem af Chus forskningsgruppe ved Stanford University.
Ifølge en fysiklov kendt som "diffraktionsgrænsen, "Det mindste billede, som et optisk system kan opløse, er omkring halvdelen af bølgelængden af det lys, der bruges til at producere dette billede. For konventionel optik, det svarer til omkring 200 nanometer. Til sammenligning, et DNA -molekyle måler cirka 2,5 nanometer i bredden.
Mens ikke-optiske billeddannelsessystemer, såsom elektronmikroskoper, kan opløse objekter langt ind i subnanometerskalaen, disse systemer fungerer under betingelser, der ikke er ideelle til undersøgelse af biologiske prøver. Detektering af individuelle fluorescerende mærker knyttet til biologiske molekyler af interesse ved hjælp af ladningskoblede enheder (CCD'er) - arrays af siliciumchips, der konverterer indkommende lys til en elektrisk ladning, har givet opløsninger så fine som fem nanometer. Imidlertid, Indtil nu har denne teknologi ikke været i stand til at afbilde enkelte molekyler eller afstande mellem et par molekyler meget mindre end 20 nanometer.
Chu og hans medforfattere var i stand til at bruge den samme CCD-fluorescensteknologi til at løse afstande med subnanometer præcision og nøjagtighed ved at korrigere et trick af lyset. De elektriske ladninger i et CCD -array dannes, når fotoner rammer silicium og fjerner elektroner, hvor styrken af ladningen er proportional med intensiteten af de indfaldende fotoner. Imidlertid, afhængigt af præcis hvor en foton rammer overfladen af en siliciumchip, der kan være en lille forskel på, hvordan fotonen absorberes, og om den genererer en målbar ladning. Denne uensartethed i CCD-siliciumarrayets respons på indkommende fotoner, hvilket sandsynligvis er en artefakt af chipfremstillingsprocessen, resulterer i en sløring af pixels, der gør det vanskeligt at løse to punkter, der er inden for et par nanometer fra hinanden.
"Vi har udviklet et aktivt feedback-system, der giver os mulighed for at placere billedet af et enkelt fluorescerende molekyle hvor som helst på CCD-arrayet med sub-pixel-præcision, hvilket igen gør os i stand til at arbejde i et område, der er mindre end den typiske tre pixel længdeskala for CCD-uensartetheden, " siger Pertsinidis, hvem er hovedforfatter på Nature -papiret. "Med dette feedback -system plus brug af yderligere optiske stråler til stabilisering af mikroskopsystemet, vi kan skabe et kalibreret område på silicium-arrayet, hvor fejlen på grund af uensartethed reduceres til 0,5 nanometer. Ved at placere de molekyler, vi ønsker at måle i midten af denne region, kan vi opnå subnanometer opløsning ved hjælp af et konventionelt optisk mikroskop, som du kan finde i ethvert biologisk laboratorium."
Chu siger, at evnen til at flytte scenen i et mikroskop små afstande og beregne det geometriske centrum (tyngdepunkt) af billedet gør det muligt ikke kun at måle foto-respons-uensartetheden mellem pixels, men også for at måle ikke-ensartetheden inden for hver enkelt pixel.
"Ved at kende denne uensartethed tillader vi os at foretage korrektioner mellem den tilsyneladende position og den reelle position af billedets tyngdepunkt, " siger Chu. "Da denne uensartede respons er indbygget i CCD-arrayet og ikke ændrer sig fra dag til dag, vores aktive feedback-system giver os mulighed for at tage billeder gentagne gange i den samme position af CCD-arrayet."
Pertsinidis fortsætter med at arbejde sammen med Chu og andre i gruppen om videreudvikling og anvendelse af denne superopløsningsteknik. Ud over det humane RNA-polymerase II-system, han og gruppen bruger det til at bestemme strukturen af de epiteliale cadherin-molekyler, der er ansvarlige for den celle-til-celle-adhæsion, der holder væv og andre biologiske materialer sammen. Pertsinidis, Zhang, og en anden postdoc i Chus forskningsgruppe, Sang Ryul Park, bruger også denne teknik til at lave 3D-målinger af den molekylære organisation inde i hjerneceller.
"Ideen er at bestemme strukturen og dynamikken i vesikelfusionsprocessen, der frigiver neurotransmittermolekylerne, der bruges af neuroner til at kommunikere med hinanden, " siger Pertsinidis. "Lige nu får vi in situ målinger med en opløsning på omkring 10 nanometer, men vi tror, vi kan skubbe denne opløsning til inden for to nanometer."
I et samarbejde med Joe Gray, Berkeley Labs Associate Director for Life Sciences og en førende kræftforsker, postdocs i Chus forskningsgruppe bruger også superopløsningsteknikken til at studere bindingen af signalmolekyler på RAS-proteinet, som har været forbundet med en række kræftformer, inklusive brystets, bugspytkirtel, lunge og tyktarm. Denne forskning kan hjælpe med at forklare, hvorfor kræftbehandlinger, der fungerer godt på nogle patienter, er ineffektive på andre.
Ud over dets biologiske anvendelser, Pertsinidis, Zhang og Chu i deres Natur papir siger, at deres superopløsningsteknik også skulle vise sig at være værdifuld til at karakterisere og designe præcisionsfotometriske billeddannelsessystemer i atomfysik eller astronomi, og give mulighed for nye værktøjer inden for optisk litografi og nanometri.
Sidste artikelNanorør passerer syretest
Næste artikelUbåde kunne bruge ny nanorørteknologi til sonar og stealth
 Varme artikler
Varme artikler
-
 Ingeniører kigger ind i nanopartikler for at udforske, hvordan deres form forbedrer energilagringStanford-ingeniører, der studerer strukturerne af faseskiftende nanopartikler, har fundet ud af, at formen betyder noget. Materialer sammensat af terninger og pyramider, for eksempel, kan give mere ef
Ingeniører kigger ind i nanopartikler for at udforske, hvordan deres form forbedrer energilagringStanford-ingeniører, der studerer strukturerne af faseskiftende nanopartikler, har fundet ud af, at formen betyder noget. Materialer sammensat af terninger og pyramider, for eksempel, kan give mere ef -
 Nyt NIST-mikroskop ser, hvad andre ikke kanDet NIST-fokuserede lithium-ion-strålemikroskop fanger og afkøler en gas af lithium-atomer til blot et par milliontedele af en grad over det absolutte nulpunkt (MOT-sektion.) En anden laser ioniserer
Nyt NIST-mikroskop ser, hvad andre ikke kanDet NIST-fokuserede lithium-ion-strålemikroskop fanger og afkøler en gas af lithium-atomer til blot et par milliontedele af en grad over det absolutte nulpunkt (MOT-sektion.) En anden laser ioniserer -
 Nye optiske sensorer svulmer, når de udsættes for målgasHøjfølsom påvisning af fortyndede gasser demonstreres ved at overvåge resonansen af en suspenderet polymer nanokavitet. Indsatsen viser målgasmolekylerne (mørkere), der interagerer med polymermateri
Nye optiske sensorer svulmer, når de udsættes for målgasHøjfølsom påvisning af fortyndede gasser demonstreres ved at overvåge resonansen af en suspenderet polymer nanokavitet. Indsatsen viser målgasmolekylerne (mørkere), der interagerer med polymermateri -
 Referencemateriale kan hjælpe med forskning i nanomaterialers toksicitetTEM-billede viser den krystallinske struktur i nanoskala af titaniumdioxid i NIST SRM 1898 (farve tilføjet for klarhedens skyld.) Kredit:Impellitteri/EPA (Phys.org) – National Institute of Standar
Referencemateriale kan hjælpe med forskning i nanomaterialers toksicitetTEM-billede viser den krystallinske struktur i nanoskala af titaniumdioxid i NIST SRM 1898 (farve tilføjet for klarhedens skyld.) Kredit:Impellitteri/EPA (Phys.org) – National Institute of Standar


