Nanoblaster fra laseraktiverede nanopartikler flytter molekyler, proteiner og DNA ind i cellerne

Et felt af humane prostatacancerceller vises efter eksponering for laseraktiverede kulstofnanopartikler. De mange grønne celler har optaget en terapeutisk modelforbindelse, calcein, mens de få rødfarvede celler er døde. Hver af de grønne eller røde pletter er en enkelt celle. Kredit:Kredit:Prerona Chakravarty
Ved at bruge kemiske "nanoblaster", der slår bittesmå huller i cellernes beskyttende membraner, forskere har demonstreret en ny teknik til at få terapeutiske små molekyler, proteiner og DNA direkte ind i levende celler.
Kulstofnanopartikler aktiveret af laserlysudbrud udløser de små eksplosioner, som åbner huller i cellemembraner lige længe nok til at lukke terapeutiske midler inde i den omgivende væske. Ved at justere lasereksponeringen, forskerne administrerede en markørforbindelse med små molekyler til 90 procent af målcellerne - mens de holdt mere end 90 procent af cellerne i live.
Forskningen blev sponsoreret af National Institutes of Health og Institute of Paper Science and Technology ved Georgia Tech. Det vil blive rapporteret i august-udgaven af tidsskriftet Natur nanoteknologi .
"Denne teknik kunne give os mulighed for at levere en bred vifte af terapeutiske midler, som nu ikke nemt kan komme ind i cellerne, " sagde Mark Prausnitz, en professor ved School of Chemical and Biomolecular Engineering ved Georgia Institute of Technology. "En af de mest betydningsfulde anvendelser af denne teknologi kunne være gen-baserede terapier, som giver store løfter inden for medicin, men hvis fremskridt har været begrænset af vanskeligheden ved at få DNA og RNA ind i cellerne."
Arbejdet menes at være det første til at bruge aktivering af reaktive kulstof-nanopartikler med lasere til medicinske anvendelser. Yderligere forskning og kliniske forsøg vil være nødvendige, før teknikken kan bruges på mennesker.
Forskere har i årtier forsøgt at drive DNA og RNA mere effektivt ind i celler med en række forskellige metoder, herunder brug af vira til at transportere genetiske materialer ind i celler, belægning af DNA og RNA med kemiske midler eller ved at anvende elektriske felter og ultralyd til at åbne cellemembraner. Imidlertid, disse tidligere metoder har generelt lidt af lav effektivitet eller sikkerhedsproblemer.
Med deres nye teknik, som var inspireret af tidligere arbejde med den såkaldte "fotoakustiske effekt, "Prausnitz og samarbejdspartnere Prerona Chakravarty, Wei Qian og Mostafa El-Sayed håber på bedre at lokalisere anvendelsen af energi til cellemembraner, skabe en sikrere og mere effektiv tilgang til intracellulær lægemiddellevering.
Deres teknik begynder med at indføre partikler af kønrøg, der måler 25 nanometer - en milliontedel af en tomme - i diameter i væsken, der omgiver cellerne, hvori de terapeutiske midler skal indføres. Udbrud af nær-infrarødt lys fra en femotosekund-laser påføres derefter væsken med en hastighed på 90 millioner pulser i sekundet. Kulstofnanopartiklerne absorberer lyset, hvilket gør dem varme. De varme partikler opvarmer derefter den omgivende væske for at lave damp. Dampen reagerer med carbonnanopartiklerne og danner brint og carbonmonoxid.
De to gasser danner en boble, som vokser, efterhånden som laseren giver energi. Boblen kollapser pludselig, når laseren slukkes, skabe en chokbølge, der slår huller i membranerne af nærliggende celler. Åbningerne tillader terapeutiske midler fra den omgivende væske at trænge ind i cellerne. Hullerne lukkes hurtigt, så cellen kan overleve.
Forskerne har vist, at de kunne få det lille molekyle calcein, det bovine serumalbuminprotein og plasmid-DNA gennem cellemembranerne i humane prostatacancerceller og rottegliosarkomceller ved hjælp af denne teknik. Calceinoptagelse blev set i 90 procent af cellerne ved laserniveauer, der efterlod mere end 90 procent af cellerne i live.
"Vi kunne få næsten alle cellerne til at optage disse molekyler, som normalt ikke ville komme ind i cellerne, og næsten alle cellerne forblev i live, " sagde Prerona Chakravarty, undersøgelsens hovedforfatter. "Vores laseraktiverede carbon-nanopartikelsystem muliggør kontrollerede bobleimplosioner, der kan forstyrre cellemembranerne lige nok til at få molekylerne ind uden at forårsage varig skade."
For at vurdere, hvor længe hullerne i cellemembranen forblev åbne, forskerne efterlod de simulerede terapier ude af væsken, da cellerne blev udsat for laserlyset, tilføjede derefter midlerne et sekund efter at have slukket laseren. De så næsten ingen optagelse af molekylerne, tyder på, at cellemembranerne genforseglede sig selv hurtigt.
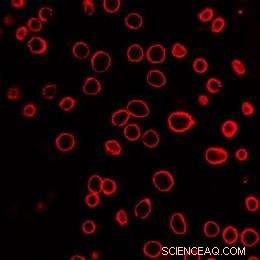
Et felt af humane prostatacancerceller vises efter eksponering for laseraktiverede kulstofnanopartikler. Cellemembranerne er farvet røde for at hjælpe med visualisering. Hver af de røde cirkler er en enkelt celle. Kredit:Kredit:Prerona Chakravarty
For at bekræfte, at kulstof-dampreaktionen var en kritisk faktor, der drev nanoblasterne, forskerne erstattede kulstofnanopartiklerne med guldnanopartikler, før de blev udsat for laserlys. Fordi de manglede det nødvendige kulstof til reaktion, guld-nanopartiklerne producerede ringe optagelse af molekylerne, Prausnitz bemærkede.
Tilsvarende forskerne erstattede kulstofnanopartiklerne med kulstofnanorør, og målte også lidt optagelse, hvilket de forklarede ved at bemærke, at nanorørene er mindre reaktive end carbon black-partiklerne.
Eksperimenter viste yderligere, at DNA indført i celler gennem den laseraktiverede teknik forblev funktionelt og i stand til at drive proteinekspression. Når plasmid-DNA, der kodede for luciferase-ekspression, blev introduceret i kræftcellerne, produktionen af luciferase steg 17 gange.
For fremtiden, forskerne planlægger at undersøge brugen af en billigere nanosekund-laser til at erstatte det ultrahurtige femtosekund-instrument, der bruges i forskningen. De planlægger også at optimere kulstofnanopartiklerne, så næsten alle af dem forbruges under eksponeringen for laserlys. Tilbageværende kulstofnanopartikler i kroppen bør ikke have nogen skadelige virkninger, selvom kroppen måske ikke er i stand til at fjerne dem, Prausnitz bemærkede.
"Dette er den første undersøgelse, der viser proof of princip for laseraktivering af reaktive kulstofnanopartikler til lægemiddel- og genlevering, " sagde han. "Der er en betydelig vej forude, før dette kan bringes ind i medicin, men vi er optimistiske over, at denne tilgang i sidste ende kan give et nyt alternativ til at levere terapeutiske midler til celler sikkert og effektivt."
Sidste artikelFly Eye baner vejen for fremstilling af biomimetiske overflader
Næste artikelX-Ray Vision:se plastikblandinger inde og ude
 Varme artikler
Varme artikler
-
 Flere grupper hævder at skabe de første atomtykke siliciumpladerBillede af den todimensionelle bikagestruktur af silicen som fanget af et scanning tunneling mikroskop. Kredit:Guy Le Lay et al./TU Berlin (PhysOrg.com) -- Siden opdagelsen i 2004, grafen - plader
Flere grupper hævder at skabe de første atomtykke siliciumpladerBillede af den todimensionelle bikagestruktur af silicen som fanget af et scanning tunneling mikroskop. Kredit:Guy Le Lay et al./TU Berlin (PhysOrg.com) -- Siden opdagelsen i 2004, grafen - plader -
 Kulstofnanopartikler bryder barrierer - og det er måske ikke godtDisse er enkeltvæggede og flervæggede kulstof nanorør, de typer af nanopartikler, der forårsagede ændringer i nyreceller i Indiana University-Purdue University Indianapolis undersøgelsen. Kredit:Tilpa
Kulstofnanopartikler bryder barrierer - og det er måske ikke godtDisse er enkeltvæggede og flervæggede kulstof nanorør, de typer af nanopartikler, der forårsagede ændringer i nyreceller i Indiana University-Purdue University Indianapolis undersøgelsen. Kredit:Tilpa -
 Ny biosensor kunne overvåge glukoseniveauer i tårer og svedKredit:American Chemical Society Konstant sporing af en persons glukoseniveauer gennem deres tårer eller sved kan være et skridt tættere på at give mennesker med diabetes et forbedret overvågnings
Ny biosensor kunne overvåge glukoseniveauer i tårer og svedKredit:American Chemical Society Konstant sporing af en persons glukoseniveauer gennem deres tårer eller sved kan være et skridt tættere på at give mennesker med diabetes et forbedret overvågnings -
 Grafen kvanteprikker kan føre til billige solceller og OLED'erEt transmissionselektronmikroskopibillede af grafen kvanteprikker. Billedkredit:Gupta, et al. © 2011 American Chemical Society (PhysOrg.com)-Fremstilling af fotovoltaiske enheder-dem, der konverte
Grafen kvanteprikker kan føre til billige solceller og OLED'erEt transmissionselektronmikroskopibillede af grafen kvanteprikker. Billedkredit:Gupta, et al. © 2011 American Chemical Society (PhysOrg.com)-Fremstilling af fotovoltaiske enheder-dem, der konverte
- Ny undersøgelse ser på handel med nitrogenkreditter for at anspore væksten af flodbuffere
- Landemærker, der står over for klimatrusler, kan transformere, siger ekspert
- Fotonik bryder selvom baner vejen for forbedrede trådløse kommunikationssystemer
- Sådan farves krystaller
- Hvad forårsager Double Helix at vride i et DNA-billede?
- Find bedre magneter hurtigere med 3D-metalprintprototyper


